Типи кристалічних решіток
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 3. ХІМІЧНИЙ ЗВ’ЯЗОК
§ 3.7. Типи кристалічних решіток
Тверді речовини, як правило, мають кристалічну будову. Вона характеризується правильним розміщенням частинок у чітко визначених точках простору. При уявному з’єднанні цих точок прямими лініями, що перетинаються, утворюється просторовий каркас, який називають кристалічною решіткою. Точки, в яких розміщені частинки, називаються вузлами кристалічної решітки. У вузлах уявної решітки
Залежно від виду частинок і характеру зв’язку між ними розрізняють чотири типи кристалічних решіток: іонні, атомні, молекулярні й металічні.
Кристалічні решітки, що складаються з іонів, називаються іонними. їх утворюють речовини з іонними зв’язками. Прикладом може бути кристал хлориду натрію, в якому, як уже зазначалося, кожен іон натрію оточений шістьма хлорид-іонами, а кожен хлорид-іон – шістьма іонами натрію.
Число найближчих сусідніх частинок, які щільно приєднуються до даної частинки в кристалі або в окремій молекулі, називається координаційним числом.
У решітці хлориду натрію координаційні числа обох іонів дорівнюють 6. Отже, в кристалі хлориду натрію неможливо виділити окремі молекули солі. їх немає. Весь кристал слід розглядати як гігантськумакромолекулу, що складається з однакового числа іонів Na+ і Сl – , NanCln, де n – велике число (див. рис. 3.15). Зв’язки між іонами у такому кристалі досить міцні. Тому речовини з іонною решіткою мають порівняно високу твердість. Вони тугоплавкі й малолеткі.
Плавлення іонних кристалів спричиняє до порушення геометрично правильної орієнтації іонів один відносно одного і зменшення міцності зв’язку між ними. Тому їх розплави проводять електричний струм. Іонні сполуки, як правило, легко розчиняються в рідинах, що складаються з полярних молекул, наприклад у воді.
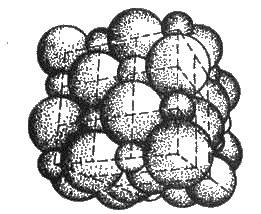
Рис. 3.15. Просторове розміщення іонів в іонній решітці NaCl (дрібні кульки – іони натрію)
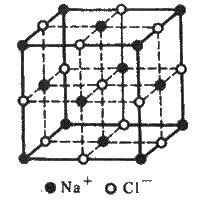
Рис. 3.16. Кристалічна решітка NaCl
Кристалічні решітки, у вузлах яких розміщуються окремі атоми, називаються атомними. Атоми в таких решітках сполучені між собою міцними ковалентними зв’язками. Прикладом може бути алмаз – одна з модифікацій карбону. Алмаз складається з атомів карбону, кожен з яких зв’язаний з чотирма сусідніми атомами. Координаційне число карбону в алмазі – 4. Структура алмазу подана на рис. 11.1. У решітці алмазу, як і в решітці хлориду натрію, молекул немає. Весь кристал слід розглядати як гігантську молекулу. В неорганічній хімії відома значна кількість речовин з атомною кристалічною решіткою. Вони мають високі температури плавлення (для алмазу понад З 500°С), міцні й тверді, практично не розчинні у рідинах. Атомна кристалічна решітка характерна для твердого бору, кремнію, германію і сполук деяких елементів з карбоном та силіцієм. Кристалічні решітки, що складаються з молекул (полярних і неполярних), називаються молекулярними. Молекули в таких решітках з’єднані між собою порівняно слабкими міжмолекулярними силами. Тому речовини з молекулярною решіткою мають малу твердість і низькі температури плавлення, нерозчинні або малорозчинні у воді, їх розчини майже не проводять електричного струму. Число неорганічних речовин з молекулярною решіткою незначне. Прикладами їх є лід, твердий оксид карбону(ІV) (“сухий лід”), тверді галогеноводні, тверді прості речовини, утворені одно – (благородні гази), двох – (F2, Сl2, Вr2, l2, Н2, О2, N2), трьох – (О3), чотирьох – (Р4), восьми – (S8) атомними молекулами. Молекулярна кристалічна решітка йоду подана на рис. 3.17. Більшість кристалічних органічних сполук мають молекулярну решітку.
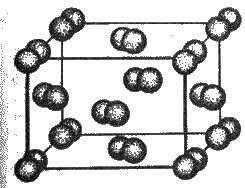
Рис. 3.17. Кристалічна решітка йоду
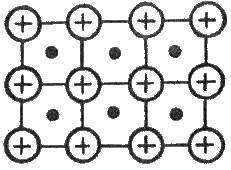
Рис. 3.18. Схематичне зображення металічної решітки
У твердому стані метали утворюють металічні кристалічні решітки. Останні звичайно описують як поєднання катіонів металу, сполучених в одне ціле валентними електронами, тобто негативно зарядженим “електронним газом”. Електрони електростатично притягуються катіонами, що забезпечує стабільність решітки. На рис. 3.18 подано схематичне зображення металічної решітки. На рис. 3.18 подано схематичне зображення металічної решітки (вільні електрони зображені точками). Порівняйте її з іншими типами кристалічних решіток.