ВАЛЕНТНІСТЬ І ЕЛЕКТРОННА БУДОВА АТОМІВ
Хімія – універсальний довідник
ВІД НАТРІЮ ДО АРГОНУ
ВАЛЕНТНІСТЬ І ЕЛЕКТРОННА БУДОВА АТОМІВ
Для схематичного зображення електронної будови атомів часто використовується наступна форма: записують символ елемента і навколо нього крапками позначають електрони зовнішнього валентного рівня. Для елементів 3-го періоду такий запис матиме вигляд:
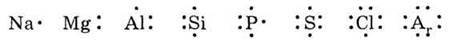
Розглянемо валентності, які можуть проявляти атоми цих елементів. Як зазначалося вище, за одиницю валентності взято валентність Гідрогену, тому, насамперед,
Гідроген має єдиний електрон на 1s-АO, він же, відповідно, і валентний. Під час взаємодії з атомом Натрію перекриваються Зs-АО Nа і 1s-АO Н, утворюючи зв’язуючу МО.
Схему утворення хімічного зв’язку можна представити так:
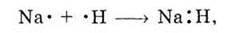
Де електронна пара між атомами Натрію і Гідрогену символізує два електрони на зв’язуючій МО. Атом Натрію з’єднався з одним атомом Гідрогену, тобто Натрій одновалентний.
Аналогічним способом запишемо схему утворення гідриду алюмінію:
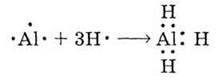
У цьому випадку утворюється три зв’язуючих
Таким чином, в атомів металів Nа і Аl (це ж стосується і Mg) валентності дорівнюють кількості валентних електронів. А ця кількість дорівнює номеру групи у періодичній системі. Саме про це говорилося вище – валентність металічних елементів А груп дорівнює номеру групи.
Розглянемо тепер елементи, розташовані у кінці третього періоду.
В атомі Хлору на зовнішньому енергетичному рівні є лише одна АО з одним електроном (на всіх інших по два). Тільки вона може утворити з Гідрогеном двохелектронний зв’язок:
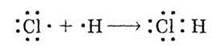
На зовнішньому енергетичному рівні атома Сульфуру таких орбіталей (які мають по одному електрону) дві, тому можливе утворення двох зв’язуючих молекулярних орбіталей:
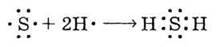
Отже, Хлор одновалентний, а Сульфур – двовалентний.
Таким чином, в атомів Сl, S, а також Р валентність дорівнює кількості вільних місць на їх АО зовнішнього рівня. Очевидно, що ця кількість утворюється, якщо від 8 (загальне число місць на чотирьох АО зовнішнього рівня) відняти кількість наявних на зовнішньому рівні електронів (дорівнює номеру групи). Це нижча валентність неметалічних елементів. Нижчу валентність атоми неметалів проявляють не тільки у сполуках з Гідрогеном, але й в усіх сполуках з металами.
Величина валентності, якщо вона змінна, залежить від умов проведення реакції. При високих температурах, як відомо, складні молекули руйнуються, тому при підвищених температурах стабільніші низькі валентності.
Підводячи підсумки обговорення зв’язку валентності елемента з його електронною будовою, можна сказати, що валентність, яку проявляє елемент, визначається однозначно в обох випадках.
Валентність дорівнює номеру групи, якщо це метал А групи, і різниці між числом 8 і номером групи, якщо це елемент, що знаходиться правіше і (або) вище свого партнера у таблиці Д. І. Менделєєва.
В інших випадках валентність залежить від умов одержання даної сполуки.