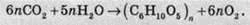Вода – ГІДРОГЕН. ВОДЕНЬ. ВОДА
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
ГІДРОГЕН. ВОДЕНЬ. ВОДА
Вода
Мабуть, на Землі немає більш поширеної і водночас більш загадкової речовини, ніж вода в рідкій і твердій фазах. Дійсно, досить пригадати, що все живе вийшло з води і складається з неї більш ніж на 50 %, що 71 % поверхні Землі вкрито водою і льодом, а значна частина північних територій суходолу являє собою вічну мерзлоту.
Отже, молекула води побудована з двох атомів Гідрогену й одного атома Оксигену. У
Лід
З точки зору звичайної людини, лід більш-менш однаковий незалежно від того, де він утворюється: в атмосфері у вигляді градинок, на краях дахів у вигляді бурульок чи у водоймищах у вигляді пластин. З точки зору фізики є безліч різновидів
Проте гексагональна фаза далеко не єдина форма існування льоду. Точне число інших кристалічних фаз – поліморфних форм льоду – досі невідоме. Вони утворюються за високого тиску і низьких температур. Одні дослідники вважають точно встановленою наявність 12 таких фаз, тоді як інші налічують їх до 14. Звичайно, це не єдина речовина, якій властивий поліморфізм, але кількість різних фаз льоду, які продовжують відкривати і по сьогоднішній день, вражає. Усе сказане вище стосувалося впорядкованого розташування іонів Оксигену в кристалічних гратках льоду. Що стосується протонів – іонів Гідрогену,- то в їхньому розташуванні існує сильний безлад. Таким чином, кристалічний лід є і добре впорядкованим середовищем (за Оксигеном) і одночасно невпорядкованим (за Гідрогеном).
Іноді здається, що лід піддатливий і текучий. Так воно і є, якщо температура близька до точки плавлення (тобто t = 0 °С за атмосферного тиску), а навантаження діє тривалий час. Та й найжорсткіший матеріал (наприклад, метал) за температур, близьких до точки плавлення, поводиться аналогічним чином.
Не менш дивовижні й електричні властивості льоду. Величина провідності та її експоненціальне швидке зростання з підвищенням температури різко відрізняють лід від металічних провідників і ставлять його в один ряд з напівпровідниками. Лише у 50-ті роки XX століття було встановлено, що носіями заряду в льоду є невпорядковані протони, тобто лід є протонним напівпровідником.
Зазвичай лід буває хімічно дуже чистий, навіть якщо росте з брудної води або розчину (пригадайте чисті прозорі крижинки у брудній калюжі). Це зумовлено низькою розчинністю домішок у структурі льоду. У результаті під час замерзання домішки відтісняються на фронті кристалізації в рідину і не входять до структури льоду. Саме тому сніг, який щойно випав, завжди білий, а вода з нього відзначається винятковою чистотою. Природа мудро передбачила гігантську очисну станцію для води у масштабі всієї атмосфери Землі.
Плавлення приповерхневих шарів льоду під дією сонячного світла, теплішої атмосфери або твердого тіла, що ковзає по ньому (ковзани, лижі, полози санок), має вирішальне значення для реалізації низького коефіцієнта тертя. Низьке тертя ковзання не результат пониження температури плавлення під дією підвищеного тиску, як часто думають, а наслідок виділення теплоти тертя. Розрахунок показує, що ефект тиску навіть у разі ковзання гостро наточеного ковзана по льоду, під яким розвивається тиск близько 1 МПа, приводить до пониження температури плавлення всього лише на ~ 0,1 °С, що не може істотно вплинути на величину тертя.
Фізичні властивості води
Чи не найважливішою аномалією води є дуже висока питома теплота плавлення (кристалізації) і теплоємність, тобто лід важко розтопити, а воду – заморозити. У результаті клімат на нашій планеті в цілому достатньо м’який, але за відсутності води (наприклад, у пустелях жаркої Африки) контраст між денною і нічною температурами значно вищий, ніж на узбережжі океану на тій самій широті. Життєво важливою для біосфери є властивість збільшуватися в об’ємі при кристалізації, а не зменшуватися, як це робить абсолютна більшість відомих речовин. У результаті лід плаває у воді, а не тоне, і сильно уповільнює промерзання водоймищ у холодну пору, захищаючи все живе, що переховується в ньому на зиму. Цьому також сприяє і немонотонна зміна густини води при пониженні температури до 0 °С – одна з найвідоміших аномальних властивостей води, виявлена понад 300 років тому. Максимум густини досягається за t = 4 °С, і це запобігає опусканню на дно приповерхневих шарів води, які прохололи до температури нижче 4 °С. Конвективне перемішування рідини блокується, що дуже сповільнює подальше охолоджування. Досить давно відомі й інші аномалії води: в’язкості за 20 °С, питомої теплоємності за 40 °С, ізотермічної стисливості за 46 °С, швидкості поширення звуку за 60 °С. В’язкість води із зростанням тиску зменшується, а не збільшується, як в інших рідин. Ясно, що аномальні властивості води зумовлені структурними особливостями її молекули і специфікою міжмолекулярних взаємодій.
У дуже переохолодженої води є дві характерні температури th = -36 °С і tg = -140 °С. Добре очищена і позбавлена газу вода, що перебуває в інтервалі температур 0 °С > t > th, тривалий час може залишатися в стані переохолодженої рідини. За tg < t < th відбувається гомогенне зародження кристалів льоду, і вода не може перебувати в переохолодженому стані за будь-якого ступеня очищення. В умовах достатньо швидкого охолоджування за t < tg рухливість молекул води настільки падає (а в’язкість зростає), що вона утворює склоподібне тверде тіло з аморфною структурою, властивою рідинам. При цьому в ділянці невисоких тисків утворюється аморфна фаза низької густини, а в ділянці підвищених – аморфна фаза високої густини, тобто вода демонструє поліаморфізм. У разі змін тиску або температури одна аморфна фаза стрибком переходить в іншу з несподівано великою зміною густини (> 20 %).
Поведінка переохолодженої води становить великий інтерес через різні причини. Зокрема, вона визначає кліматичні умови, можливість і режим судноплавства у високих широтах.
Процеси танення льоду на перший погляд здаються легшими для аналізу, ніж процеси кристалізації. Проте й вони залишають безліч питань. Так, наприклад, дуже поширена думка, що тала вода якийсь час має властивості, відмінні від властивостей води звичайної, принаймні щодо біологічних об’єктів: рослин, тварин, людини. Ймовірно, ці особливості можуть бути зумовлені високою хімічною чистотою (через зазначений малий коефіцієнт захоплення домішок у процесі кристалізації льоду), відмінностями у вмісті розчинених газів і іонів, а також запам’ятовуванням структури льоду в багатомолекулярних кластерах рідкої фази. Проте достовірної інформації про це, отриманої сучасними фізичними методами, немає.
Не менш складним видається аналіз механізмів впливу зовнішніх фізичних полів, зокрема магнітного, на процеси та властивості води, льоду і фазових переходів. Усе наше життя проходить в умовах постійної дії магнітного поля Землі і його слабких флуктуацій. Протягом багатьох століть розвиваються магнітобіологія і магнітні методи лікування в медицині. Нарешті, серійно виробляються і широко застосовуються установки для намагнічування води, яку використовують для поливу в сільському господарстві (в цілях підвищення врожайності), живлення парових котлів (для зменшення швидкості утворення накипу в них) тощо. Проте хоч якогось задовільного фізичного опису механізмів дії магнітного поля в цих та інших подібних випадках досі немає.
Хімічні властивості води
Вода – дуже активна в хімічному відношенні речовина.
1) Вода реагує з багатьма металами з виділенням водню:
2Na + 2Н2O = Н2 + 2NaOH (бурхливо),
2К + 2Н2O = Н2 + 2КOН (бурхливо),
3Fe + 4Н2O = 4Н2 + Fe3O4 (тільки під час нагрівання).
Не всі, а тільки достатньо активні метали можуть брати участь в окисно-відновних реакціях цього типу. Найлегше реагують лужні та лужноземельні метали І і II груп.
З неметалів з водою реагують, наприклад, вуглець і його воднева сполука (метан). Ці речовини набагато менш активні, ніж метали, але все-таки здатні реагувати з водою за високої температури:
С + Н2O = Н2 + СО (під час сильного нагрівання)
СН4 + 2Н2O = 4Н2 + СO2 (під час сильного нагрівання)
2) Вода розкладається на водень і кисень у результаті дії електричного струму. Це також окисно-відновна реакція, де вода є одночасно і окисником, і відновником:
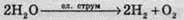
3) Вода реагує з багатьма оксидами неметалів. На відміну від попередніх, ці реакції не окисно-відновні, а реакції сполучення:
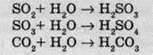
4) Деякі оксиди металів також можуть вступати в реакції сполучення з водою:
СаО + Н2O → Са(ОН)2.
Не всі оксиди металів здатні реагувати з водою. Частина з них практично не розчинна у воді і тому з водою не реагує. Це ZnO, ТіO2, Сr2O3, з яких готують, наприклад, стійкі до води фарби. Оксиди Феруму також не розчинні у воді і не реагують з нею.
5) Вода утворює численні сполуки, у яких її молекула повністю зберігається. Це так звані гідрати. Якщо гідрат кристалічний, то він називається кристалогідратом. Наприклад:
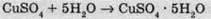
Не тільки солі здатні утворювати гідрати:
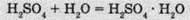
(гідрат сульфатної кислоти)
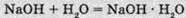
(гідрат їдкого натру)
Сполуки, що зв’язують воду в гідрати та кристалогідрати, використовують як осушувачі. За їх допомогою, наприклад, видаляють водяні пари з вологого атмосферного повітря.
6) Особлива реакція води – синтез рослинами крохмалю (С6Н10О5)n та інших подібних сполук (вуглеводів), що відбувається з виділенням кисню: