ВЗАЄМОДІЯ ГАЛОГЕНІВ З МЕТАЛАМИ
Хімія – універсальний довідник
ГАЛОГЕНИ
ВЗАЄМОДІЯ ГАЛОГЕНІВ З МЕТАЛАМИ
Хімічні властивості галогенів, тобто здатність вступати в реакції, утворювати ті або інші сполуки, визначаються їхнім місцем у періодичній системі. Кожен галоген практично завершує період, у якому він знаходиться.
Розглянемо спочатку утворення сполуки одного з галогенів, а саме – Хлору з Натрієм.
Електронна формула атома Натрію 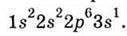 Він має одну валентну АО (Зs). Електронна формула атома Хлору
Він має одну валентну АО (Зs). Електронна формула атома Хлору 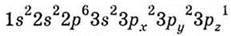 . У нього
. У нього
Через велику різницю в енергіях АО, що перекриваються АО (-496 кДж/моль для Зs-АО Натрію і -1250 кДж/моль для Зр-АО Хлору), зв’язуюча МО, що утворюється, мало відрізняється за енергією від АО атома Сl. Електрон атома Натрію, розташований на більш високій Зs-АО, практично переходить на значно нижчу Зр-АО атома Хлору.
Можна сказати, що атом Nа “віддав”
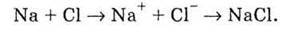
Чи утвориться при цьому молекула NаСl? Тут треба врахувати, що електрозаряджена частинка, в тому числі iон, може притягувати як завгодно багато інших, що мають протилежний заряд, тому iон натрію Nа+ притягує до себе не один iон хлору Сl-, а стільки, скільки біля нього може розміститися. Одночасно ідентично поводиться iон Сl-. В результаті утворюється кристалічна гратка з іонів Nа+ і Сl-.
Таким чином, речовина хлорид натрію, його кристали, утворені не молекулами, а іонами. Таку ж іонну будову мають і інші сполуки металів із неметалами.
На відміну від речовин із молекулярною будовою (Н2, О2, F2, Н2O і т. п.) іонні речовини мають значно вищі температури плавлення і кипіння. Наприклад, для кухонної солі NаСl tПЛ = 801°С, tКИП = 1465 °С.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- БУДОВА АТОМІВ ГАЛОГЕНІВ Хімія – універсальний довідник ГАЛОГЕНИ Галогенами називаються хімічні елементи VІІА групи. Ця загальна назва походить від грец. “галс” – сіль і “генес” – той, що народжує, тобто “солероди”. У галогенів яскравіше порівняно з іншими елементами виражені властивості неметалів. Кажуть, галогени – типові неметали. БУДОВА АТОМІВ ГАЛОГЕНІВ З галогенів у періодичній системі елементів першим розташований Флуор […]...
- Виявлення галогенів – Якісний аналіз – Визначення формули АНАЛІЗ ОРГАНІЧНИХ СПОЛУК Виявлення галогенів Сполуки, що містять галогени, при нагріванні на мідному листі утворюють галогеніди купруму. Галогеніди забарвлюють полум’я в інтенсивний зелений колір (проба Бейльштейна). Увага: пряме виявлення галогенів за допомогою іонів Аргентуму в більшості органічних сполук неможливе. На відміну від неорганічних речовин атоми галогенів утворюють не іонні, а полярні зв’язки....
- Загальна характеристика підгрупи галогенів – ВОДЕНЬ. ГАЛОГЕНИ-НЕОРГАНІЧНА ХІМІЯ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 8. ВОДЕНЬ. ГАЛОГЕНИ § 8.5. Загальна характеристика підгрупи галогенів Під час розгляду хімії елементів за підгрупами винятково важливо вміти використовувати прогнозуючу роль періодичного закону і періодичної системи елементів Д. І. Менделєєва. Тоді багато властивостей елементів і їх сполук можна описати, не […]...
- Деякі сполуки галогенів – ГАЛОГЕНИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЯ ЕЛЕМЕНТІВ ГАЛОГЕНИ Деякі сполуки галогенів Оксигеновмісні кислоти Хлору Характеристика оксигеновмісних кислот Хлору Формула кислоти Ступінь окиснення атома Хлору Назва кислоти Назва аніона Сила кислоти Стійкість кислоти HClO +1 Гіпохлоритна Гіпохлорит Дуже слабка Дуже нестійка HClO2 +3 Хлоритна Хлорит Середньої сили Існує тільки […]...
- Іонний зв’язок Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ Іонний зв’язок Утворення іонного зв’язку Іонний зв’язок за механізмом утворення нагадує ковалентний, але має принципову відмінність: у речовинах з іонним зв’язком атоми жорстко не з’єднуються один з одним, а просто притягуються електростатичними взаємодіями. Атоми лужних металів, наприклад Натрію, […]...
- ОКИСНІ ВЛАСТИВОСТІ ГАЛОГЕНІВ Хімія – універсальний довідник ГАЛОГЕНИ ОКИСНІ ВЛАСТИВОСТІ ГАЛОГЕНІВ Кожен галоген, що стоїть у періодичній системі вище, являючись сильнішим окисником, ніж той, що стоїть нижче, витискає його зі сполук з металами. Наприклад: Висока окисна активність галогенів виявляється в їх високій хімічній, а тому і біологічній активності. Навіть найслабший серед них окисник, Йод, має антисептичну дію – […]...
- Хімічні властивості спиртів: повне й часткове окиснення, дегідратація, взаємодія з лужними металами, гідрогенгалогенідами II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 30 Тема уроку. Хімічні властивості спиртів: повне й часткове окиснення, дегідратація, взаємодія з лужними металами, гідрогенгалогенідами Цілі уроку: вивчити хімічні властивості спиртів на прикладі насичених одноатомних спиртів – їх повного окиснення, взаємодії з металевим натрієм, гідроген хлоридом; показати зв’язок хімічних властивостей спиртів з наявністю функціональної гідроксильної групи; […]...
- Взаємодія нітратної кислоти з металами і неметалами – ПІДГРУПА НІТРОГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 10. ПІДГРУПА НІТРОГЕНУ § 10.8. Взаємодія нітратної кислоти з металами і неметалами При взаємодії нітратної кислоти з металами водень, як правило, не виділяється: він окиснюється, утворюючи воду. Кислота ж, залежно від концентрації і активності металу, може відновлюватися до сполук: +5 +4 […]...
- Взаємодія сульфатної кислоти H2SO4 з металами – ХІМІЯ Формули й таблиці ХІМІЯ Взаємодія сульфатної кислоти ( H 2 SO 4 ) з металами Концентрація кислоти Метали (в електрохімічному ряді напруг) Продукти взаємодії Розведена Зліва від Гідрогену Справа від Гідрогену Не взаємодіє Концентрована Fe, Cr, Аl, Pt, Au Не взаємодіє Зліва від Гідрогену Справа від Гідрогену...
- Взаємодія нітратної кислоти HNO3 з металами – ХІМІЯ Формули й таблиці ХІМІЯ Взаємодія нітратної кислоти ( HNO 3 ) з металами Концентрація кислоти Метали (в електрохімічному ряді напруг) Продукти взаємодії Розведена Від Li до Zn з дуже розведеною HNO3 Від Fe до Н з дуже розведеною HNO3 Справа від Гідрогену Концентрована Fe, Cr, Аl, Pt, Au, Os, Іr, Та, W Не взаємодіє Від […]...
- Хімічні властивості карбонових кислот: електролітична дисоціація, взаємодія з металами, лугами, солями, спиртами. Кислотність карбонових кислот, її залежність від складу й будови. Взаємний вплив карбоксильної та вуглеводневої груп II Семестр Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 38 Тема уроку. Хімічні властивості карбонових кислот: електролітична дисоціація, взаємодія з металами, лугами, солями, спиртами. Кислотність карбонових кислот, її залежність від складу й будови. Взаємний вплив карбоксильної та вуглеводневої груп Цілі уроку: формувати знання учнів про хімічні властивості одноосновних карбонових кислот; показати взаємний вплив карбоксильної групи та […]...
- Йонний зв’язок – Йонний, металічний і водневий зв’язки ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.7. Йонний, металічний і водневий зв’язки 3.7.1. Йонний зв’язок Якщо різниця електронегативностей пари атомів, що утворюють зв’язок, > 1,7 (за Полінгом), між ними утворюється йонний зв’язок. Зазвичай йонний зв’язок утворюється між металічними і неметалічними елементами. Атоми металічних елементів віддають електрони […]...
- Іонний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку При утворенні хімічного зв’язку атоми, що беруть участь у ньому, намагаються набути конфігурації інертного газу. Оскільки при цьому задіяні лише оболонки валентних електронів, то для зображення атома використовують так звану формулу Льюїса, в якій зображені лише валентні електрони. Приклад. Зображення електронної будови атома Натрію і атома Хлору та […]...
- Внутрішня енергія кристалічних речовин – Зміна енергії при кристалізації і розчиненні ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 2 . Зміна енергії при кристалізації і розчиненні У твердому агрегатному стані речовини утворюють, як правило, гратку, в якій частинки впорядковано сполучені між собою. Взаємодія між іонами обумовлена кулонівськими силами, між молекулами – вандерваальсовими силами. 2.1. Внутрішня енергія кристалічних речовин Утворення кристалічної гратки зі складових частинок – це екзотермічний процес. Енергію, яка […]...
- Йонний зв’язок Хімія Загальна хімія Хімічний зв’язок Йонний зв’язок Йонний зв’язок – це зв’язок, зумовлений електростатичним тяжінням між різнойменно зарядженими йонами. Під час утворення йонного зв’язку один з атомів віддає електрон, перетворюючись на позитивно заряджений іон – катіоН, а інший приймає електрон, перетворюючись на негативно заряджений іон – аніоН. Різниця між електронегативностями атомів, які утворюють йонний зв’язок, […]...
- Хімічні властивості: повне й часткове окиснення, заміщення, приєднання водню, галогенів, галогеноводнів. Одержання й використання алкінів І СЕМЕСТР Тема 2. ВУГЛЕВОДНІ Урок 15 Тема уроку. Хімічні властивості: повне й часткове окиснення, заміщення, приєднання водню, галогенів, галогеноводнів. Одержання й використання алкінів Цілі уроку: формувати знання учнів про хімічні властивості алкінів; розкрити хімічні властивості ненасичених вуглеводнів на прикладі алкінів, зумовлені наявністю кратного зв’язку, їх взаємодію з розчинами кислот, лугів, калій перманганату; формувати знання […]...
- Солі натрію і калію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.4. Солі натрію і калію Натрій утворює солі з усіма кислотами. Майже всі його солі розчинні у воді. Найважливіші з них – хлорид натрію (кухонна сіль), сода і сульфат натрію. Хлорид натрію NaCl – необхідна приправа […]...
- ВАЛЕНТНІСТЬ І ЕЛЕКТРОННА БУДОВА АТОМІВ Хімія – універсальний довідник ВІД НАТРІЮ ДО АРГОНУ ВАЛЕНТНІСТЬ І ЕЛЕКТРОННА БУДОВА АТОМІВ Для схематичного зображення електронної будови атомів часто використовується наступна форма: записують символ елемента і навколо нього крапками позначають електрони зовнішнього валентного рівня. Для елементів 3-го періоду такий запис матиме вигляд: Розглянемо валентності, які можуть проявляти атоми цих елементів. Як зазначалося вище, за […]...
- Заряд й електромагнітна взаємодія 1-й семестр ЕЛЕКТРОМАГНІТНІ ЯВИЩА 1. Електричне поле – Заряд й електромагнітна взаємодія – Електричне поле – Електроскоп – Закон Кулона Тематичне планування № з/п Тема уроку Дата проведення 1 Заряд й електромагнітна взаємодія 2 Електричне поле 3 Механізм електризації різних тіл. Електроскоп 4 Лабораторна робота № 1 “Дослідження взаємодії заряджених тіл” 5 Закон Кулона 6 […]...
- Хімічні властивості алкенів: повне й часткове окиснення, приєднання водню, галогенів, гідрогенгалогенідів, води, полімеризація. Правило В. В. Марковнікова, механізм реакції приєднання за подвійним зв’язком. Одержання й використання алкенів І СЕМЕСТР Тема 2. ВУГЛЕВОДНІ Урок 13 Тема уроку. Хімічні властивості алкенів: повне й часткове окиснення, приєднання водню, галогенів, гідрогенгалогенідів, води, полімеризація. Правило В. В. Марковнікова, механізм реакції приєднання за подвійним зв’язком. Одержання й використання алкенів Цілі уроку: формувати в учнів знання про хімічні властивості алкенів; розкрити хімічні властивості ненасичених вуглеводнів на прикладі етену та […]...
- Хлор ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.2. Галогени Галогени – це Флуор (F), Хлор (Сl), Бром (Вr), Йод (І) і Астат (At). Вони розміщуються у головній підгрупі VII групи1. Усі галогени, крім Астату2, трапляються в природі. Загальна електронна формула галогенів – ns2np5 […]...
- Іонний зв’язок Тема 4 ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ УРОК 57 Тема. Іонний зв’язок Цілі уроку: розширити знання учнів про будову атомів металів і не – металів на прикладі утворення іонів; ознайомити учнів з механізмом утворення іонного зв’язку; розвивати навички складання електронних формул речовин. Тип уроку: засвоєння нових знань, умінь і навичок. Форми роботи: розповідь учителя, самостійна […]...
- Будова електронних оболонок та властивості хімічних елементів Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ БУДОВА АТОМА Будова електронних оболонок та властивості хімічних елементів Металічні й неметалічні елементи Хімічні властивості елементів обумовлюються не всіма електронами, а тільки тими, які мають найбільшу енергію. Ці електрони називають валентними. В атомах елементів головних підгруп валентними е електрони зовнішнього енергетичного рівня. Завершені […]...
- Характеристика хімічних елементів – ГАЛОГЕНИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЯ ЕЛЕМЕНТІВ ГАЛОГЕНИ Характеристика хімічних елементів Властивості хімічних елементів Властивість Флуор Хлор Бром Йод Хімічний символ F Сl Вr І Порядковий номер 9 17 35 85 Атомна маса 18,99840 35,453 79,904 126,9045 Місце в ПС 2 період; VII група 3 період; VII група […]...
- Стійкість електронних шарів. Перетворення атомів на йони – Електрон. Електронні шари ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 2. Будова атома 2.4. Електрон. Електронні шари 2.4.3. Стійкість електронних шарів. Перетворення атомів на йони Найстійкішою електронною конфігурацією атома є така, при якій у зовнішньому електронному шарі розміщується 2 (як р атома Гелію) або 8 е – (як в атомах інших інертних газів). […]...
- Натрій і Калій як представники лужних металів – Метали Хімія Неорганічна хімія Метали Натрій і Калій як представники лужних металів Лужні метали Розміщені в IА групі (у I групі головної підгрупи) Періодичної системи. На зовнішньому енергетичному рівні у лужних металів розміщений один неспарений електрон, який легко віддається окисникам. Ступінь окиснення лужних металів у сполуках дорівнює +1. Електронна конфігурація атома Натрію: Електронна конфігурація атома Калію: […]...
- ЕЛЕКТРОННА БУДОВА АТОМА Хімія – універсальний довідник БУДОВА АТОМА ЕЛЕКТРОННА БУДОВА АТОМА Хімічні властивості визначаються електронною будовою атома. Описати електронну будова атома – це означає, насамперед, зазначити розподіл електронної густини біля ядра, тобто визначити ділянку простору, де можуть знаходитися електрони даного атома. Але для повного опису електронної будови атома цього недостатньо. Найважливішою характеристикою руху електрона на даній орбіталі […]...
- Зображення орбіталей БУДОВА АТОМА 6 . Хвильова модель 6.2 . Зображення орбіталей Щоб наочно показати конфігурацію електронів атома, Л. Паулі запропонував зображувати його орбіталі у вигляді електронних комірок. Електрони в них зображають вертикальними стрілками. Для розпізнавання спінового квантового числа стрілки направлені у протилежних напрямах. Запам’ятайте: два електрони з протилежним спіном, які знаходяться на одній і тій самій […]...
- ГАЛГТ Екологія – охорона природи ГАЛГТ, кам’яна сіль – безбарвний, прозорий, зі скляним блиском мінерал класу хлоридів. Використовують Г. у харч, пром-сті, для добування хлору й натрію....
- РУХ ЕЛЕКТРОНА В АТОМІ Хімія – універсальний довідник БУДОВА АТОМА РУХ ЕЛЕКТРОНА В АТОМІ Розглянемо стан електронів в атомі. Зрозуміло, електрони не можуть бути нерухомими. Якби електрон був нерухомим, то під дією сили притягання до позитивно зарядженого ядра він негайно впав би на ядро. Але електрон і не обертається навколо ядра. Рух електрона, як і інших часток субатомних розмірів […]...
- Загальна характеристика підгрупи нітрогену – ПІДГРУПА НІТРОГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 10. ПІДГРУПА НІТРОГЕНУ § 10.1. Загальна характеристика підгрупи нітрогену Підгрупу нітрогену складають п’ять елементів: нітроген, фосфор, стибій, арсен і бісмут. Це р-елементи V групи періодичної системи Д. І. Менделєєва. На зовнішньому енергетичному рівні їх атоми мають по п’ять електронів – ns2 […]...
- ЗАБРУДНЕННЯ ВАЖКИМИ МЕТАЛАМИ Екологія – охорона природи ЗАБРУДНЕННЯ ВАЖКИМИ МЕТАЛАМИ – процес локального, регіонального і глобального нагромадження свинцю, ртуті, кадмію та ін. важких металів на поверхні Землі. Шляхи потрапляння цих металів у середовище різні (тертя мет. деталей, корозія, викиди двигунів внутр. згоряння, тепло – енергет. пристроїв тощо), але нагромаджуються вони в основному внаслідок вилучення їх із надр землі […]...
- СІЛЬ, ЩО ЇЇ РОЗСИПАЮТЬ НА ДОРОГАХ ДЛЯ ПРИСКОРЕННЯ ТАНЕННЯ СНІГУ Екологія – охорона природи СІЛЬ, ЩО ЇЇ РОЗСИПАЮТЬ НА ДОРОГАХ ДЛЯ ПРИСКОРЕННЯ ТАНЕННЯ СНІГУ, – застосування великих кількостей С. протягом кількох років призводить до серйозних пошкоджень рослинності. Непрямою причиною цього стала зміна властивостей грунту, зумовлена його засоленням. Останнє призводить до вимивання йонів поживних речовин, ущільнення грунту і поступового підвищення значення рН. Унаслідок цього порушується засвоєння […]...
- ГІДРОКСИД НАТРІЮ – ЛУЖНІ МЕТАЛИ Хімія – універсальний довідник ЛУЖНІ МЕТАЛИ ГІДРОКСИД НАТРІЮ Гідроксид натрію NаОН широко відомий під назвою їдкий натр. Цю назву (історично вона була першою) він отримав завдяки високій хімічній активності стосовно тваринних тканин – “їдкості” (як і гідроксиди всіх інших лужних металів). Його технічна назва – каустична сода. Гідроксид натрію – розчинна у воді основа, тобто […]...
- Ступінь окиснення Тема 4 ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ УРОК 61 Тема. Ступінь окиснення Цілі уроку: сформувати уявлення про ступінь окиснення, розділити поняття “валентність” і “ступінь окиснення”; формувати навички визначення ступеня окиснення в сполуках за формулами, а також за будовою атомів, що утворюють ці сполуки. Тип уроку: засвоєння нових знань, умінь і навичок. Форми роботи: розповідь учителя, […]...
- ГІДРОГЕН ЯК ХІМІЧНИЙ ЕЛЕМЕНТ – ВОДЕНЬ Хімія – універсальний довідник ВОДЕНЬ ГІДРОГЕН ЯК ХІМІЧНИЙ ЕЛЕМЕНТ У сполуках Гідроген одновалентний (його валентність прийнята за 1). Він утворює сполуки з переважною більшістю хімічних елементів (крім інертних газів і деяких металів В груп). У сполуках з Гідрогеном усі неметали проявляють свою нижчу валентність. Сполуки Гідрогену з металами називаються гідридами. Наприклад, NаН – гідрид натрію, […]...
- Аміни, їхній склад, хімічна, електронна будова, класифікація. Аміни як органічні основи. Взаємодія амінів з водою й кислотами, горіння II Семестр Тема 5. НІТРОГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ Урок 50 Тема уроку. Аміни, їхній склад, хімічна, електронна будова, класифікація. Аміни як органічні основи. Взаємодія амінів з водою й кислотами, горіння Цілі уроку: розширити знання учнів про різноманіття органічних сполук на прикладі нітрогеновмісних сполук; ознайомити з класифікацією амінів, їхніми фізичними й хімічними властивостями; дати уявлення про будову […]...
- Добування амінокислот – АМІНОКИСЛОТИ Й БІЛКИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ АМІНОКИСЛОТИ Й БІЛКИ Добування амінокислот Основний спосіб добування амінокислот – заміщення атома галогену на аміногрупу в галогенозамінених кислотах. Цей спосіб аналогічний до добування амінів з алкіл галогенів та аміаку. Галогеноводень, який виділяється при заміщенні, зв’язують надлишком аміаку:...
- Електронегативність – Здатність атомів утворювати сполуки ХІМІЧНИЙ ЗВ’ ЯЗОК 1.3. Електронегативність Енергія іонізації показує, наскільки легко атом втрачає електрон. Спорідненість до електрона визначає здатність нейтрального атома приймати електрон. Електронегативність (ЕН) визначає розподіл електронів в існуючому хімічному зв’язку. Вона є мірою здатності атома залучати валентні електрони до спільного зв’язку. Для оцінки ступеня електронегативності була створена відносна шкала від 1,0 для Літію до […]...
- Приклади розв’язування типових задач – Урок 3 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок Приклади розв’язування типових задач Задача 1. Укажіть кількість р-електронів, які утворюють хімічні зв’язки у молекулі хлор(І) оксиду. Розв’язання Сl2O. Будова електронних оболонок елементів Хлору і Оксигену: З формули видно, що Хлор перебуває в основному (незбудженому) стані та виявляє валентність І. […]...