Хімічна рівновага
РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ
§ 14. Хімічна рівновага
Усвідомлення змісту цього параграфа дає змогу:
Пояснювати суть хімічної рівноваги й умови її зміщення, принцип Ле Шательє;
Вміти розрізняти оборотні та необоротні реакції, записувати їх рівняння;
Керувати хімічними процесами завдяки зміщенню хімічної рівноваги і зміні швидкості хімічних реакцій.
Пригадайте, які хімічні реакції називають необоротними, а які – оборотними. Наведіть приклади. Запишіть відповідні
Вам уже відомо, що хімічні реакції, які відбуваються в одному напрямку, називають необоротними. Більшість хімічних процесів є оборотними, оскільки за одних і тих самих умов відбуваються і пряма, і зворотна реакції (особливо в замкнених системах). Наприклад:
А) реакція, рівняння якої 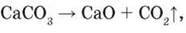 у відкритій системі необоротна;
у відкритій системі необоротна;
Б) ця сама реакція, рівняння якої 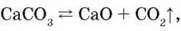 у замкненій системі оборотна.
у замкненій системі оборотна.
Під час оборотних реакцій у системі присутні як реагенти, так і продукти реакції. Співвідношення між ними змінюється тільки при зміні умов (температури, тиску,
Типовим прикладом необоротної реакції є розклад калій хлорату за наявності каталізатора:
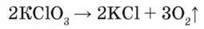
Адже добути калій хлорат KClO3 сполученням калій хлориду і кисню неможливо за будь-яких умов.
Якщо реакція оборотна, то початкові концентрації реагуючих речовин поступово зменшуються, швидкість прямої реакції також зменшується. Однак поява продуктів уможливлює перебіг зворотної реакції. З часом концентрації продуктів реакції збільшуються, як і швидкість зворотної реакції. Зрештою досягається такий стан, за якого швидкість прямої і зворотної реакцій стають однаковими: 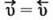
(мал. 17).
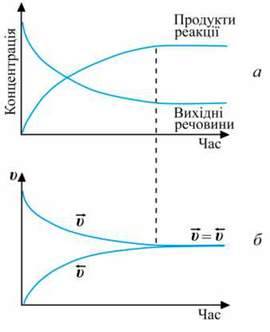
Мал. 17. Зміна концентрацій речовин (а) і швидкостей (б) оборотної реакції у системі Н2 + І2 -› 2НІ з часом
Стан реакційної системи, за якого швидкість прямої реакції дорівнює швидкості зворотної реакції, називають хімічною рівновагою.
При цьому концентрації реагуючих речовин і продуктів реакції не змінюються. Їх називають рівноважними концентраціями. На макрорівні здається, що нічого не відбувається. Насправді прямий і зворотний процеси тривають, але з однаковою швидкістю. Тому таку рівновагу в системі називають динамічною.
Стан рівноваги може зберігатися невизначено тривалий час, якщо не змінювати умови, за яких він установлюється.
Перехід системи з одного рівноважного стану в інший називається зміщенням, або зсувом, хімічної рівноваги.
На зсув рівноваги впливають концентрація, температура, тиск. Принцип, що характеризує зсув рівноваги під впливом зміни зовнішніх умов, сформулював французький учений Ле Шательє:
Якщо на рівноважну систему справляти будь-який вплив, то хімічна рівновага зміщуватиметься в бік тієї реакції, яка послаблює цей вплив.
За принципом Ле Шательє, напрям зміщення рівноваги можна передбачити. Так, якщо:
– збільшується концентрація реагуючих речовин, то хімічна рівновага системи зміщується в бік прямої реакції (утворення продуктів);
– збільшується концентрація продуктів реакції, то хімічна рівновага системи зміщується в бік зворотної реакції (утворення початкових речовин);
– підвищується тиск, то хімічна рівновага системи зміщується в бік тієї реакції, яка супроводжується зменшенням числа молів газуватих речовин; при зниженні тиску – в бік тієї реакції, яка супроводжується збільшенням числа молів газуватих речовин;
– підвищується температура, то хімічна рівновага системи зміщується в бік ендотермічної реакції, за зниження температури – в бік екзотермічного процесу.
Суттєво впливають на стан хімічної рівноваги каталізатори. Однак вони не зміщують рівновагу, бо водночас прискорюють як пряму, так і зворотну реакції. Але наявність каталізатора дає змогу пришвидшити встановлення рівноваги, що є важливим для хімічного виробництва.
Коротко про головне
Хімічні реакції бувають необоротними, бо відбуваються тільки в одному напрямку, – в бік утворення продуктів реакції, та оборотними, бо за одних і тих самих умов ідуть у прямому та зворотному напрямах.
Коли швидкості прямої і зворотної реакцій збігаються, настає стан хімічної рівноваги. Він утримується дуже довго, якщо умови не змінюються.
Під впливом зовнішніх умов відбувається зміщення хімічної рівноваги у бік тієї реакції, яка послаблює вплив цих умов (принцип Ле Шательє).
Зміщення хімічної рівноваги можна досягти збільшенням концентрації однієї з реагуючих речовин, підвищенням (або зниженням) температури чи тиску. Застосування каталізаторів лише пришвидшує досягнення стану рівноваги, однак вони не змінюють співвідношення між швидкістю прямої та зворотної реакцій.