Хімічні реакції. Класифікація реакцій
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ
§ 1.8. Хімічні реакції. Класифікація реакцій
Речовини, взаємодіючи одна з одною, зазнають різних змін і перетворень. Наприклад, берилій, взаємодіючи з оксигеном повітря за температури понад 500°С, перетворюється на оксид берилію; вугілля, згоряючи, утворює вуглекислий газ тощо.
Явища, за яких одні речовини перетворюються на інші, що відрізняються від вихідних за складом і властивостями, і при цьому не
Окиснення на повітрі, горіння, добування металів із руд, іржавіння заліза – все це хімічні явища. Інакше їх називають хімічними перетвореннями, хімічними реакціями або хімічними взаємодіями.
Слід розрізняти хімічні і фізичні явища.
Під час фізичних явищ змінюється форма чи фізичний стан речовин або утворюються нові речовини за рахунок зміни складу ядер атомів.
Наприклад, під час взаємодії газуватого аміаку з рідким азотом аміак переходить спочатку в рідкий, а потім у твердий стан, Це не хімічне, а фізичне явище, оскільки склад речовин
Фізичні явища, як і хімічні реакції, дуже поширені: проходження електричного струму по металевому провіднику (дроту), кування і плавлення металу, виділення теплоти, перетворення води на лід і пару тощо.
Хімічні явища завжди супроводжуються фізичними. Наприклад, під час згоряння магнію виділяються теплота і світло, в гальванічному елементі внаслідок хімічних реакцій виникає електричний струм.
Відповідно до атомно-молекулярного вчення і закону збереження маси (див. § 1.9) під час хімічних реакцій з атомів речовин, що вступили в реакцію, утворюються нові речовини (як прості, так і складні), причому загальна кількість атомів кожного елемента завжди залишається однаковою.
Хімічні реакції класифікують за різними ознаками.
1. За ознакою виділення або поглинання теплоти. Реакції, що відбуваються з виділенням теплоти, називаються екзотермічними. Наприклад, реакція утворення хлороводню з водню і хлору:
Н2 + Сl2 = 2НСl, АН = -184,6 кДж.
Реакції, що відбуваються з поглинанням теплоти з навколишнього середовища, називаються ендотермічними. Наприклад, реакція утворення оксиду нітрогену(ІІ) з азоту і кисню, яка відбувається за високої температури:
N2 + O2 = 2NO, АН = 180,8 кДж.
Кількість теплоти, що виділилась або поглинулась в результаті реакції, називається тепловим ефектом процесу. Розділ хімії, що вивчає теплові ефекти різних процесів, називається термохімією.
Хімічні рівняння, в яких зазначено теплові ефекти реакцій, називаються термохімічними. У таких рівняннях коефіцієнти біля формул означають число молів відповідних речовин і тому можуть бути дробовими числами. Оскільки тепловий ефект реакції залежить від температури і тиску, то домовилися зазначати його для стандартних умов, тобто за температури 25°С (298 або, точніше, 298,15 К) і тиску 101 325 Па =101,3 кПа. У термохімічних рівняннях також зазначається стан речовин: кристалічний (к), рідкий (р), газуватий (г), розчин (р-н) тощо. Тепловий ефект прийнято позначати ∆Н (читається “дельта аш”), виражати у кілоджоу лях (кДж) і відносити до того числа молів речовини, яке визначається рівнянням реакції. Знаки теплових ефектів вважаються додатними для ендотермічних процесів (теплота поглинається, ∆Н >0) і від’ємними – для екзотермічних процесів (теплота виділяється, ∆Н< 0).
Пояснимо суть теплового ефекту реакції ∆Н. Кожна речовина має певну ентальпію (тепломісткість). Ентальпія (її позначають латинською літерою Н) є мірою енергії, яка нагромаджується речовиною під час її утворення. Тепловий ефект реакції за стабільного тиску ∆Н являє собою різницю ентальпій кінцевих продуктів реакції (позначається Hкін) і вихідних речовин, що вступають у реакцію, (позначається Нвих), тобто
∆Н = Нкін – Нвих. (1.4)
У цьому фізична суть величини ∆Н (тут грецька ∆ означає різницю). Для ізобарних реакцій часто використовують термін “ентальпія процесу” замість терміна “тепловий ефект процесу”.
Якщо всі кінцеві продукти реакції і вихідні речовини перебувають у стандартному стані (Т = 298 К, р ≈ 101,3 кПа), то ∆Н називають стандартною ентальпією процесу і позначають ∆Н298 або тільки з верхнім індексом ∆Н°.
Згідно зі сказаним термохімічні рівняння екзотермічної реакції утворення хлороводню і ендотермічної реакції утворення оксиду нітрогену(ІІ) з відповідних простих речовин за стандартних умов запишуться так:
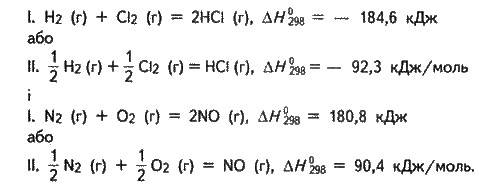
Рівняння II означають, що перетворення 0,5 моль газуватого водню і 0,5 моль газуватого хлору в 1 моль газуватого хлороводню за стандартних умов супроводжується виділенням 92.3 кДж теплоти, а перетворення 0,5 моль газуватого азоту і 0,5 моль газуватого кисню в 1 моль газуватого оксиду нітрогену(ІІ) за стандартних умов супроводжується поглинанням 90.4 кДж теплоти. У рівняннях l цих реакцій слово “моль” випущено, оскільки ∆Н стосується не одного моля, а двох. Знак “мінус” перед значенням ∆Н для екзотермічних реакцій означає, що запас енергії у продуктах реакції менший, ніж у вихідних речовинах. Знак “плюс” перед значенням Н для ендотермічних реакцій означає, що продукти реакції, поглинувши теплоту із зовнішнього середовища, збільшили свою енергію порівняно з вихідними речовинами.
Очевидно, що якщо реакція сполучення відбувається з виділенням теплоти, то протилежна їй реакція – реакція розкладу – відбуватиметься з поглинанням теплоти. Якщо ж реакція сполучення відбувається з поглинанням теплоти, то протилежна їй реакція розкладу відбуватиметься з виділенням теплоти. Так, у першому прикладі ∆H°98 утворення 1 моль хлороводню дорівнює – 92,3 кДж, а ∆H298 розкладу 1 моль хлороводню дорівнює + 92,3 кДж; у другому прикладі ∆Н 298 утворення 1 моль оксиду нітрогену(ІІ) дорівнює +90,4 кДж, а ∆Н 298 розкладу 1 моль цього самого оксиду нітрогену(ІІ) дорівнює – 90,4 кДж.
У шкільних курсах хімії та багатьох навчальних посібниках теплові ефекти реакцій позначають Q і вважають їх позитивними, якщо теплота виділяється, і негативними, якщо вона поглинається. Очевидно, ∆Н = – Q. Слід дотримуватися наведеного нами позначення теплових ефектів, оскільки воно введене для однаковості з термодинамікою.
Тепловий ефект хімічних реакцій вимірюють за допомогою спеціальних приладів – калориметрів. їх будову описано в курсах фізики і фізичної хімії.
2. За ознакою зміни числа вихідних і кінцевих речовин реакції поділяють на такі типи: сполучення, розкладу, заміщення та обміну.
Реакції, внаслідок яких з двох або кількох речовин утворюється одна нова речовина, називаються реакціями сполучення. Наприклад, взаємодія хлороводню з аміаком:
НСl + NH3 = NH4Cl
Або утворення оксиду магнію з простих речовин:
2Мg + O2 = 2МgО.
Реакції, внаслідок яких з однієї речовини утворюється кілька нових речовин, називаються реакціями розкладу. Наприклад, розклад іодоводню:
2Нl = Н2 + l2
Або розклад перманганату калію:
2КМnO4 = К2МnО4 + МnО2 + O2.
Реакції між простими і складними речовинами, внаслідок яких атоми простої речовини заміщують атоми одного з елементів складної речовини, називаються реакціями заміщення. Наприклад, заміщення плюмбуму цинком у нітраті плюмбуму(ІІ):
Pb(NO3)2 + Zn = Zn(NO3)2 + Pb
Або витіснення брому хлором:
2NaBr + Сl2 = Вr2 + 2NaCl.
Реакції, внаслідок яких дві речовини обмінюються своїми складовими частинами, утворюючи дві нові речовини, називаються реакціями обміну. Наприклад, взаємодія оксиду алюмінію із сульфатною кислотою:
Аl2О3 + 3H2SO4 = Al2(SO4)3 + ЗН2О,
Або взаємодія хлориду кальцію з нітратом аргентуму(І):
СаСl2 + 2AgNO3 = 2AgCl + Ca(NO3)2,
Або взаємодія основи з кислотою:
Са(OН)2 + 2НСl = СаСl2 + 2Н2O.
3. За ознакою оборотності реакції поділяють на оборотні та необоротні (див. § 4.5).
4. За ознакою зміни ступеня окиснення атомів, що входять до складу речовин, які реагують між собою, розрізняють реакції, що відбуваються без зміни ступенів окиснення атомів, і окисно-відновні реакції (зі зміною ступенів окиснення атомів). Про окисно-відновні реакції див. § 7.1.