Хлор
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
9.2. Галогени
Галогени – це Флуор (F), Хлор (Сl), Бром (Вr), Йод (І) і Астат (At). Вони розміщуються у головній підгрупі VII групи1. Усі галогени, крім Астату2, трапляються в природі. Загальна електронна формула галогенів – ns2np5 (n ≥ 2 – номер періоду, в якому розміщується елемент). Галогени відносять до p-елементів, оскільки в їхніх атомах електронами заповнюється саме p-підрівень зовнішнього
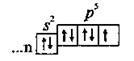
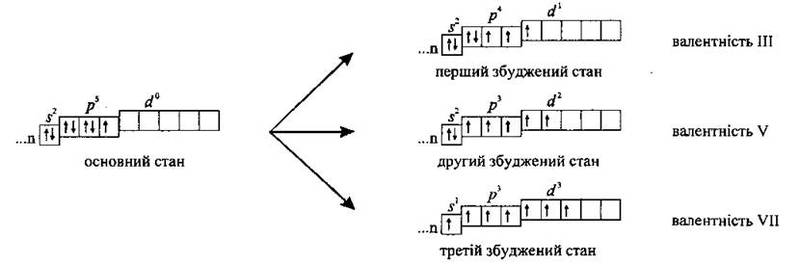
В атомів галогенів у зовнішньому електронному шарі є один неспарений електрон, а тому в основному стані їм властива лише валентність І. У збудженому стані всі галогени, окрім Флуору, можуть виявляють валентності III, V і VII, що пояснюється наявністю у них незаповненого d-підрівня з п’ятьма вільними орбіталями (d-підрівень з’являється в елементів 3 періоду), на які в збудженому стані можуть переходити електрони з s – та p-підрівнів:
Галогени відносять до типових неметалічних елементів. Серед елементів
Під час хімічних реакцій атоми галогенів приєднують один електрон, якого саме і не вистачає до октету електронів, тобто до утворення електронної конфігурації інертного газу:
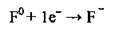
А тому галогени є сильними окисниками.
Атоми галогенів утворюють прості речовини, молекули яких у газоподібному, рідкому і кристалічному станах складаються з двох атомів: F2 (світло-жовтий газ), Сl2 (жовто-зелений газ, який легко зріджується), Вr2 (червоно-коричнева густа рідина), І2 (блискучі сіро-чорні з фіолетовим відтінком кристали). Усі галогени отруйні, мають характерний запах, відзначаються великою леткістю. Йод при незначному нагріванні сублімує3. I навпаки, при охолодженні пари йоду знову утворюють кристали.
Галогени відносять до активних неметалічних елементів. Хімічна активність галогенів (атомів і молекул) спадає в ряду від Флуору до Йоду. Активніші галогени витісняють менш активні з їхніх сполук. Окисні властивості галогенів зменшуються в підгрупі від Флуору до Йоду, оскільки зростає радіус атома і здатність приєднувати електрони зменшується. Йони галогенів (Сl-, Вr-,I-) здатні віддавати електрони, а тому виявляють відновні властивості, які збільшуються від хлорид-іона до йодид-іона.
З Гідрогеном галогени утворюють леткі сполуки, які називають гідрогенгалогенідами, або галогеноводнями: HF, НСl, НВr, НІ. Це газоподібні сполуки, які легко розчиняються у воді. Їхні водні розчини є кислотами. Утворені галогенами солі4 називають відповідно флуоридами, хлоридами, бромідами, йодидами.
У ряду кислот HF → НСl → НВr → НІ спостерігається підсилення кислотних властивостей сполук. Це пояснюється тим, що вниз по групі спостерігається збільшення радіуса атома, а тому зв’язок між Гідрогеном і галогеном послаблюється. Отже, саме в молекулах НІ, які містяться в розчині йодидної кислоти, найлегше відщеплюються йони Гідрогену.
Відомі сполуки галогенів з Оксигеном. Серед оксигеновмісних сполук галогенів стійкими є солі оксигеновмісних кислот (Флуор оксигеновмісних кислот не утворює). У ряду оксигеновмісних кислот, наприклад Хлору: НСlO → НСlO2 → НСlO3 → НСlO4, спостерігається посилення кислотних і зменшення окисних властивостей.
______________________________________________________________
1 За новою номенклатурою – у 17 групі.
2 Трапляється найрідше з усіх природних елементів, малодосліджений.
3 Сублімація – це явище переходу речовин із твердого стану в газоподібний, минаючи рідкий. Зворотній процес називають десублімацією.
4 Галогени (від гр. άλός – сіль і γενος – рід) – “ті, що народжують солі”.
9.2.1. Хлор
Хлор – 17-й елемент періодичної таблиці, заряд ядра – +17. Хімічний символ Сl. Елемент Хлор має 2 природні ізотопи: 35Сl і 37Сl; їхні масові частки дрівнюють відповідно 75,78 % і 24,22 %. Хлор утворює одну просту речовину – хлор Сl2. Відносна молекулярна маса – 71, молярна маса – 71 г/моль.
Електронна формула – 17Cl 1s22s22p63s23p5. У сполуках Хлор виявляє валентності І (в основному стані), III, V, VII (у збуджених станах). Найнижчий ступінь окиснення – -1, а найвищий – +7.
Ступені окиснення | -1 | 0 | +1 | +3 | +5 | +7 |
Приклади сполук | НСl, СаСl2 | Сl2 | HClO, KClO | HClO2; KClO2 | HClO3; KClO3 | HClO4; KClO4 |
Фізичні властивості хлору
Зв’язок у двохатомній молекулі – неполярний ковалентний. Молекули хлору у твердому стані утворюють молекулярні кристалічні гратки. За стандартних умов хлор – жовто-зелений газ із задушливим запахом, надзвичайно токсичний. Температура кипіння – -34 °С, температура плавлення – -101 °С. Хлор малорозчинний у воді. Водний розчин хлору називають хлорною водою.
Поширеність Хлору в природі
У вільному стані в природі Хлор не трапляєтеся. Однак він утворює низку природних сполук (мінералів): NaCl – кам’яна сіль (мінерал галіт), MgCl2 · 6Н2O – бішофіт, NaCl · КСl – сильвініт, КСl – сильвін, КСl · MgCl2 · 6Н2O – карналіт. Значна кількість хлоридів міститься в морській воді, у воді океанів, солончаків. Хлор є важливим компонентом тканин рослин (входить до складу хлорофілу), тварин і людини – один з найважливіших біогенних елементів.
Добування хлору
У лабораторії хлор одержують під час нагрівання концентрованої хлоридної кислоти з різними окисниками: манган(ІV) оксидом – МnO2, калій перманганатом – КМnO4, калій хлоратом (бертолетовою сіллю) – КСlO3, калій дихроматом – К2Сr2O7:

У промисловості хлор добувають електролізом концентрованого розчину NaCl із застосуванням діафрагми, що відокремлює катодний і анодний простір, або електролізом розплаву натрій хлориду:
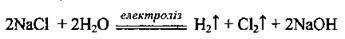
На катоді відновлюється Гідроген, а на аноді окислюється Хлор:

На катоді відновлюється Натрій, а на аноді окислюється Хлор.
Хімічні властивості хлору
Хлор доволі реакційно-здатний, взаємодіє з простими і складними речовинами, однак не реагує безпосередньо з азотом, вуглецем, киснем, інертними газами.
1. Реакції хлору з простими речовинами приводять до утворення сполук, які називають хлоридами:
А) з неметалами:
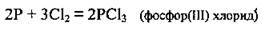
Або якщо хлор у надлишку:
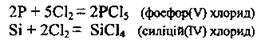
При освітленні суміш водню з хлором вибухає:
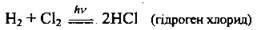
Б) з металами:
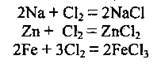
2. Реакції зі складними речовинами:
А) при взаємодії хлору з водою утворюються дві кислоти – хлоридна та хлоратна(І) (гіпохлоритна). У цій реакції молекули хлору диспропорціонують (підвищують і понижують ступінь окиснення):
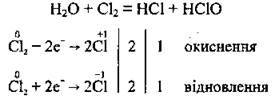
Реакція хлору з водою відбувається не до кінця, а тому у водному розчині хлору містяться молекули Сl2, Н2O та певна кількість молекул НСlO, а також іони Н+, Сl-, СlO-. Хлоратна(І) кислота нестійка, вона розкладається на хлоридну кислоту й атомарний Оксиген:
НСЮ = НСl + О
Атомарний Оксиген має дезінфекційні та відбілювальні властивості. Ось чому хлорна вода є сильним окиснювачем. Сумарне рівняння реакції:
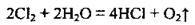
Б) при взаємодії з лугами утворюються різні продукти залежно від умов перебігу реакції:
– пропускаючи хлор крізь холодний розчин, одержують жавелеву воду (суміш натрій хлориду і натрій гіпохлориту):
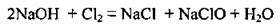
– пропускаючи хлор крізь гарячий розчин, одержують калій хлорид і калій хлорат (ця реакція, як і попередня, належить до реакцій самоокиснення – самовідновлення; обидві реакції є необоротними):
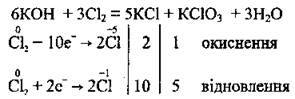
В) хлор окислює броміди та йодиди металічних елементів, витісняючи менш електронегативні галогени їхніх солей:
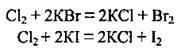
Г) хлор взаємодіє зі складними речовинами, що є відновниками:
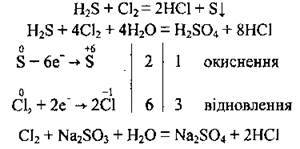
3. Взаємодія з органічними речовинами (алканами, алкенами, алкінами, аренами тощо):

Застосування хлору
Хлор іде на виробництво хлороводню, хлоридної кислоти, хлоридів, відбілювальних засобів, хлоровмісних органічних сполук (лікарських препаратів, пластмас, каучуків, інсектицидів), дезінфекцію води.