Суть електролізу – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ
§ 7.6. Суть електролізу
У розчинах і розплавах електролітів є різнойменні за знаками іони (катіони й аніони), які подібно до всіх частинок рідини перебувають у хаотичному русі. Якщо в такий розчин або розплав електроліту, наприклад у розплав хлориду натрію (NaCl плавиться при 801 °С), занурити інертні (вугільні) електроди і пропустити постійний електричний струм, то іони рухатимуться до електродів: катіони
А хлорид-іони Сl-, віддавши електрони аноду, окиснюються:
2Сl – 2е – = Сl2.
В результаті на катоді виділяється металічний натрій, а на аноді – хлор.
Якщо тепер почленно додати рівняння цих двох електродних реакцій (попередньо помноживши перше з них на 2), то дістанемо загальне, або сумарне, рівняння електролізу хлориду натрію:
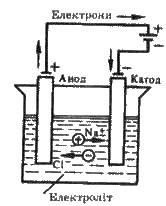
Рис. 7.2. Схема електролізу розплаву NaCl
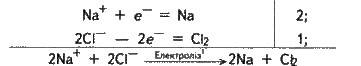
Або

Електролізом називається окисно-відновний процес, що відбувається на електродах під час проходження електричного струму крізь розплав або розчин електроліту.
Суть електролізу полягає у здійсненні за рахунок електричної енергії хімічних реакцій – відновлення на катоді й окиснення на аноді. При цьому катод віддає електрони катіонам, а анод приєднує електрони від аніонів.
Відновна й окисна дія електричного струму в багато разів сильніша, ніж дія хімічних відновників і окисників. Так, жоден хімічний окисник неспроможний відняти у фторид-іона F – його електрон. Тому протягом довгого часу фтор не могли добути у вільному стані, хоча його сполуки значно поширені у природі. Відняти електрон у фторид-іона вдалося лише при електролізі розчину фториду калію у фтороводневій кислоті. У цьому випадку на аноді вибіляється флуор (2F – 2е – = F2), а на катоді – гідроген (2Н+2е-= Н2).
Суть електролізу зручно зображувати за допомогою схеми, яка показує дисоціацію електроліту, напрямок руху іонів, процеси на електродах і речовини, що виділяються. Схема електролізу розплаву хлориду натрію має такий вигляд:
NaCl
Катод Na+ + Сl – -> Анод
Na+ е – = Na 2Сl – – 2е – = Сl2
Для проведення електролізу електроди занурюють у розплав або розчин електроліту і з’єднують їх з джерелом постійного струму. Прилад, у якому проводять електроліз, називають електролізером, або електролітичною ванною (див. рис. 7.2).
1 Слово “електроліз” над стрілкою вказує, що процес відбувається при пропусканні електричного струму.
Ця реакція є окисно-відновною: на аноді відбувається процес окиснення, на катоді – процес відновлення.




 (1 votes, average: 5.00 out of 5)
(1 votes, average: 5.00 out of 5)Related posts:
- Електроліз водних розчинів електролітів – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.7. Електроліз водних розчинів електролітів Слід розрізняти електроліз розплавлених електролітів і їх розчинів. В останньому випадку в процесах можуть брати участь молекули води. Як приклад розглянемо електроліз концентрованого водного розчину хлориду натрію (електроди вугільні). В цьому […]...
- Застосування електролізу – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.8. Застосування електролізу Електроліз знаходить досить широке застосування. Для захисту металевих виробів від корозії на їх поверхню наносять дуже тонкий шар іншого металу – хрому, срібла, золота, міді, нікелю тощо, іноді застосовують багатошарові покриття. Наприклад, зовнішні […]...
- Розв’язування типових задач – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.9. Розв’язування типових задач Окисно-відновні реакції Задача 1. Доберіть коефіцієнти у схемі окисно-відновної реакції: S + HNO3 −> H2SO4 + NO. Розв’язання. Коефіцієнти знаходимо методом електронного балансу. Зазначимо ступені окиснення елементів, які їх змінюють: 0 +5 […]...
- Електроліз розчинів та розплавів електролітів – ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Електроліз розчинів та розплавів електролітів Сукупність ОВР, які протікають на електродах у розчинах та розплавах електролітів при пропусканні через них електричного струму, називають електролізом. На підставі етимології слова можна сказати, що електроліз (від електро… і грец. лізіс – розклад) – це […]...
- Теорія окисно-відновних реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.1. Теорія окисно-відновних реакцій Усі хімічні реакції можна розділити на два типи. До першого належать реакції, які відбуваються без зміни ступеня окиснення атомів, що входять до складу реагуючих речовин. Наприклад: +1 +5 -2 +1 -2 +1 […]...
- Загальні способи добування металів. Електроліз розплавів солей і лугів – Метали Хімія Неорганічна хімія Метали Загальні способи добування металів. Електроліз розплавів солей і лугів Металургія – це галузь промисловості, яка займається видобуванням металів із руд. Електроліз – окисно-відновний процес, що відбувається на електродах під час проходження електричного струму через розплав або розчин електроліту. Якщо в розплав електроліту, наприклад натрій хлориду, занурити інертні електроди й пропускати постійний […]...
- Складання рівнянь окисно-відновних реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.3. Складання рівнянь окисно-відновних реакцій Застосовуються два методи складання рівнянь окисно – відновних реакцій – метод електронного балансу і метод напівреакцій. Метод електронного балансу. За цим методом порівнюють ступені окиснення атомів у вихідних і кінцевих речовинах, […]...
- Найважливіші окисники і відновники – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.2. Найважливіші окисники і відновники Відновники і окисники можуть бути як простими речовинами, тобто такими, що складаються з одного елемента, так і складними. Відповідно до їх місця в періодичній системі елементів атоми більшості металів містять на […]...
- Окисно-відновні реакції – ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Окисно-відновні реакції За зміною ступенів окиснення елементів, що входять до складу реагентів та продуктів реакції, усі хімічні реакції можна розділити на дві групи, а саме на: 1) Реакції, що протікають без зміни ступенів окиснення всіх елементів. До таких реакцій належать, зокрема, […]...
- Вплив середовища на характер перебігу реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.4. Вплив середовища на характер перебігу реакцій Реакції окиснення – відновлення можуть відбуватися в різних середовищах: у кислому (надлишок Н+-іонів), нейтральному (Н2О) і лужному (надлишок гідроксид-іонів ОН – ). Залежно від середовища може змінюватись і характер […]...
- Класифікація окисно-відновних реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.5. Класифікація окисно-відновних реакцій Звичайно розрізняють три типи окисно-відновних реакцій: міжмолекулярні, внутрішньомолекулярні і реакції диспропорціонування. До міжмолекулярних належать реакції, у яких окисник і відновник входять до складу різних речовин. Розглянуті в §7.3 І 7.4 реакції належать […]...
- Електроліз розплавів – Електроліз ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.13. Електроліз Електроліз – це сукупність окисно-відновних процесів, які відбуваються на електродах під час проходження електричного струму крізь розчин або розплав електроліту. Якщо крізь розчин електроліту пропускати постійний електричний струм, то позитивно заряджені частинки (катіони) будуть рухатися до катода […]...
- Рівновага в окисно-відновних реакціях – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції Окисно-відновна реакція складається з двох напівреакцій: напівреакції окиснення і напівреакції відновлення. Окиснення – це віддача електронів, відновлення – отримання електронів. Приклад. При згоранні магнію атоми Магнію окислюються, а молекули кисню відновлюються. При цьому кожен атом Магнію віддає два електрони кожному атому Оксигену. 1.1. Рівновага в окисно-відновних реакціях На відміну […]...
- Електроліз РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ § 55. Електроліз Усвідомлення змісту цього параграфа дає змогу: Формулювати означення електролізу; Пояснювати суть електролізу розплавів і розчинів солей; Прогнозувати склад продуктів електролізу: розплавів солей, розчинів солей за активністю йонів у розчині; Складати рівняння реакцій електролізу, схеми окисно-відновних процесів на електродах; Характеризувати практичне значення електролізу. Значна кількість металів […]...
- Рівняння окисно-відновної реакції – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції 1.3. Рівняння окисно-відновної реакції Дуже часто важко скласти рівняння окисно-відновної реакції, якщо невідомо, як саме реагують речовини одна з одною. Використовуючи ступінь окиснення елементів, цю проблему можна вирішити. Перед складанням рівняння окисно-відновної реакції потрібно знати наступне: – який продукт окиснення і продукт відновлення утворюється; – чи проходить реакція в […]...
- Електроліз водних розчинів електролітів (кислот, основ, солей) – Електроліз ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.13. Електроліз 6.13.2. Електроліз водних розчинів електролітів (кислот, основ, солей) Під час електролізу водних розчинів електролітів, крім катіонів і аніонів розчиненої речовини, у процесах окиснення і відновлення, що відбуваються на електродах, можуть брати участь молекули води. При цьому можуть […]...
- Окисно-відновні реакції. Метод електронного балансу Хімія Загальна хімія Окисно-відновні реакції. Метод електронного балансу Реакції, які відбуваються зі зміною ступенів окиснення елементів реагуючих речовин, називаються окисно-відновнимИ. Атоми, які під час утворення хімічних зв’язків у сполуці “приймають” електрони від інших менш електронегативних атомів, називаються окисникамИ. Процес “прийому” електронів називається відновленняМ. Атоми, які під час утворення хімічних зв’язків у сполуці “віддають” електрони іншим […]...
- Окисно-відновні реакції РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ § 10. Окисно-відновні реакції Усвідомлення змісту цього параграфа дає змогу: Пояснювати значення окисно-відновних реакцій, суть процесів окиснення й відновлення, понять окисник і відновник; визначати окисник і відновник; складати схеми електронного балансу; Розставляти коефіцієнти у рівняннях окисно-відновних реакцій. Пригадаємо означення: Реакції, під час яких змінюються […]...
- Їдкі луги – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.3. Їдкі луги Їдкими лугами називаються добре розчинні у воді гідроксиди. Найважливіші з них NaOH та КОН. Гідроксид натрію і гідроксид калію – білі, непрозорі, тверді кристалічні речовини. У воді добре розчиняються з виділенням великої кількості […]...
- ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Окисно-відновні реакції проходять за рахунок переходу електронів або атомів від одних частинок до інших. У реакції Відбувається перехід електронів від атомів заліза (відновник) до іонів Купруму (окисник). В реакції Відбувається перехід атомів Оксигену від іонів СlO – (окисник) до йонів SO32- […]...
- Тема 10. Окисно-відновні реакції Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ БУДОВА РЕЧОВИНИ Тема 10. Окисно-відновні реакції Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Вкажіть схему, що відповідає перетворенню Мg° → Мg+2: 2. Вкажіть схему, що відповідає перетворенню N0 → N-3: 3. Вкажіть схему, що відповідає перетворенню N0 → N+3: […]...
- ЗАКОН ЕЛЕКТРОЛІЗУ. ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ – СТРУМ В ЕЛЕКТРОЛІТАХ Фізика підготовка до ЗНО комплексне видання ЕЛЕКТРОДИНАМІКА 3. ЕЛЕКТРИЧНИЙ СТРУМ У РІЗНИХ СЕРЕДОВИЩАХ 3.2. СТРУМ В ЕЛЕКТРОЛІТАХ 3.2.2. ЗАКОН ЕЛЕКТРОЛІЗУ. ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ Електроліз – виділення речовини на електродах при проходженні струму через електроліт. Електроліз супроводжується окисно-відновними реакціями. Закон електролізу (закон Фарадея). Маса виділеної на електроді речовини прямо пропорційна заряду, що пройшов через електроліт: Тут k […]...
- Хімічні реакції. Окисно-відновні реакції I СЕМЕСТР ПОВТОРЕННЯ ОСНОВНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ (4 год.) УРОК 4 Тема уроку. Хімічні реакції. Окисно-відновні реакції Цілі уроку: актуалізувати знання учнів про хімічні реакції; удосконалювати вміння й навички складання повних і скорочених іонно-молекулярних та окисно-відновних рівнянь реакції; узагальнити уявлення учнів про швидкість хімічної реакції, хімічну рівновагу й фактори, що впливають на швидкість […]...
- ЕЛЕКТРОЛІЗ ВОДИ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ЕЛЕКТРОЛІЗ ВОДИ Електроліз води – окисно-відновний процес розкладу води з утворенням водню і кисню. На катоді відбувається відновлення води з утворенням іонів ОН – і молекул Н2: На аноді здійснюється окиснення води з утворенням молекул О2 і іонів Н+: Дія електричного струму призводить […]...
- Ступінь окиснення – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції 1.2. Ступінь окиснення Водень і хлор реагують під час яскраво вираженої екзотермічної реакції, перетворюючись на гідроген хлорид: Н2 + Сl2 → 2НСl. Ця реакція також окисно-відновна, хоча в цьому випадку, власне, переходу електронів не відбувається. У молекулі гідроген хлориду атом Гідрогену зв’язаний з атомом Хлору спільною парою електронів. Щоб […]...
- Окисно-відновні реакції Тема 4 ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ УРОК 64 Тема. Окисно-відновні реакції Цілі уроку: поглибити знання учнів про ступінь окиснення на прикладі окисно-відновних реакцій; розвивати навички написання хімічних рівнянь на прикладі найпростіших окисно-відновних реакцій; відпрацювати навички й уміння визначати ступені окиснення атомів хімічних елементів за хімічною формулою. Тип уроку: узагальнення й систематизації знань, умінь і […]...
- Окисно-відновні реакції, їх значення Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 27 Тема уроку. Окисно-відновні реакції, їх значення Цілі уроку: розширити знання учнів про хімічні реакції на прикладі окисно-відновних; закріпити навички складання хімічних рівнянь на прикладі найпростіших окисно-відновних реакцій, застосування методу електронного балансу для розміщення коефіцієнтів у рівняннях хімічних реакцій, що протікають зі зміною ступеня окиснення. Тип уроку: узагальнення й систематизації […]...
- Складання рівнянь окисно-відновних реакцій – ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Складання рівнянь окисно-відновних Реакцій При складанні рівнянь ОВР дуже часто користаються методом електронного балансу та методом електронно-іонного балансу (метод напівреакцій). їх використовують для підбору стехіометричних коефіцієнтів у рівняннях ОВР. Метод електронного балансу Суть методу знаходження стехіометричних коефіцієнтів у рівняннях ОВР полягає […]...
- Окисники й відновники – ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Окисники й відновники Розгляньмо, які речовини можуть виступати в ролі окисників та відновників. Окисники Окисниками можуть бути частинки, які здатні приймати електрони. До таких частинок належать: 1) нейтральні атоми та молекули неметалів; 2) позитивно заряджені іони металів, складні іони та молекули, […]...
- Лабораторна робота № 9 “Дослідження явища електролізу” 1-й семестр ЕЛЕКТРОМАГНІТНІ ЯВИЩА 2. Електричний струм Урок 27/33 Тема. Лабораторна робота № 9 “Дослідження явища електролізу” Мета уроку: експериментально перевірити виконання закону електролізу. Тип уроку: урок контролю й оцінювання знань. Обладнання: електролітична ванна з водним розчином мідного купоросу (CuSO4) і мідними електродами, джерело струму, секундомір, амперметр, ваги з важком, фільтрувальний папір, ключ, з’єднувальні проводи. […]...
- Напруга розкладу – Електроліз ОКИСНЕННЯ І ВІДНОВЛЕННЯ 4 . Електроліз Електроліз – це зворотний процес окисно-відновної реакції, що спонтанно протікає в батареї. При використанні електричної енергії примусово викликають процес окисно-відновної реакції. Водночас електрична енергія перетворюється на хімічну енергію. В обох випадках електрод, на якому відбувається окиснення, називають анодом (анодний протектор). Електрод, на якому відбувається відновлення, називають катодом. У батареї […]...
- Закони Фарадея – Електроліз ОКИСНЕННЯ І ВІДНОВЛЕННЯ 4 . Електроліз 4.2 . Закони Фарадея Чим довше триває процес електролізу, тим більше речовини осідає на електродах. Між масою т, що осіла, і зарядом Q = І ∙ t, що проходить, існує лінійна залежність: m1 ~ Q і m2 ~ Q. Перший закон Фарадея: маси речовин, що осідають на електродах, пропорційні […]...
- Застосування електролізу 1-й семестр ЕЛЕКТРОМАГНІТНІ ЯВИЩА 2. Електричний струм Урок 26/32 Тема. Застосування електролізу Мета уроку: ознайомити учнів з технічним застосуванням електролізу; навчити їх застосовувати закон електролізу Фарадея під час розв’язання задач. Тип уроку: урок вивчення нового матеріалу. План уроку Контроль знань 5 хв. 1. Рухом яких заряджених частинок створюється струм у рідинах? 2. У чому полягає […]...
- ЕЛЕКТРИЧНИЙ СТРУМ В ЕЛЕКТРОЛІТАХ. ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ “ЕЛЕКТРИЧНИЙ СТРУМ В ЕЛЕКТРОЛІТАХ. ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ” Інтегрований урок з фізики й хімії Мета. Дати учням уявлення про електроліз як окисно-відновний процес; розвивати вміння спостерігати, аналізувати фізичні й хімічні явища, робити висновки; закріпити поняття “електролітична дисоціація”, “окисно-відновні реакції”, показати єдність законів фізики і хімії. Тип уроку. Урок вивчення нового матеріалу. Обладнання. Таблиця “Електроліз солей”, чеканка, позолочені […]...
- РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ У розчинах електролітів у хімічну взаємодію вступають іони. З’ясуємо, у яких випадках це відбувається. Якщо змішати водні розчини кухонної солі (хлориду натрію) і вапняної води (розчину гідроксиду кальцію), то зовнішніх змін не спостерігається. Формально можна написати З огляду на те, що всі чотири речовини (хлорид і […]...
- Роль електроліту – Батареї – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.3. Батареї Батарея складається з трьох частин: – негативний електрод, що віддає електрони при проходженні струму, тобто окислюється; – позитивний електрод, що отримує електрони при проходженні струму, тобто відновлюється; – електроліт, який має хорошу електричну провідність і тому забезпечує низький / внутрішній опір батареї. Приклад. Широко вживана батарея – лужна […]...
- Натрій і калій – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.2. Натрій і калій Поширення в природі. В природі лужні метали у вільному стані не трапляються. Натрій і калій входять до складу різних сполук. Найважливішою є сполука натрію з хлором NaCl, яка утворює поклади кам’яної солі […]...
- Реакції іонного обміну – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.11. Реакції іонного обміну Згідно з теорією електролітичної дисоціації всі реакції у водних розчинах електролітів є реакціями між іонами. Вони називаються іонними реакціями, а рівняння цих реакцій – іонними рівняннями. Вони простіші, ніж рівняння реакцій, […]...
- ГАЛЬВАНІЧНИЙ ЕЛЕМЕНТ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ГАЛЬВАНІЧНИЙ ЕЛЕМЕНТ Гальванічний елемент – хімічне джерело струму за рахунок здійснення окисно-відновної реакції. (Хімічна енергія системи перетворюється на електричну). Дія гальванічного елемента грунтується на просторовому поділі процесів окиснення і відновлення між двома компонентами, які не торкаються один одного, – металом і розчином солі […]...
- Солі натрію і калію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.4. Солі натрію і калію Натрій утворює солі з усіма кислотами. Майже всі його солі розчинні у воді. Найважливіші з них – хлорид натрію (кухонна сіль), сода і сульфат натрію. Хлорид натрію NaCl – необхідна приправа […]...