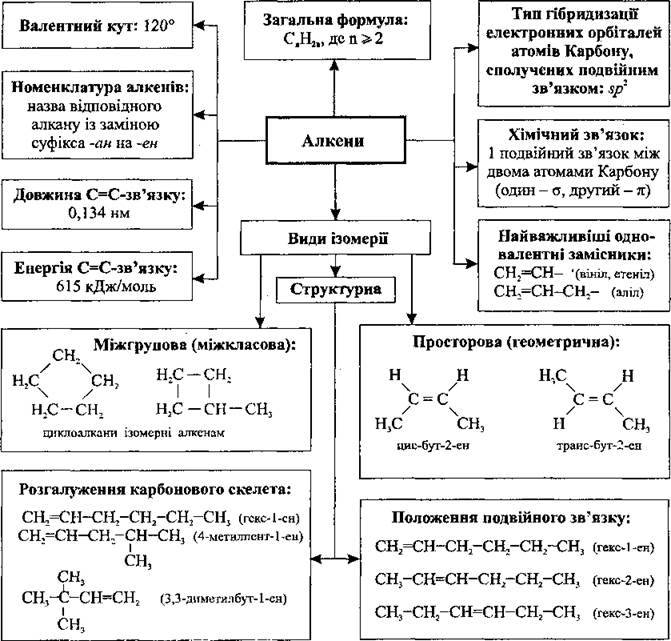
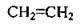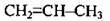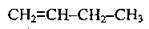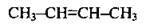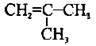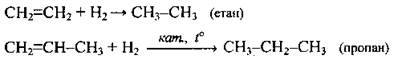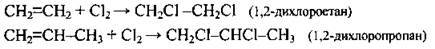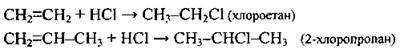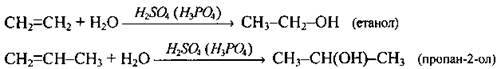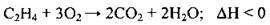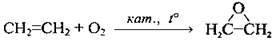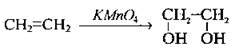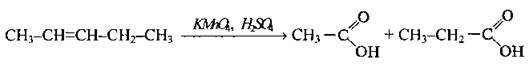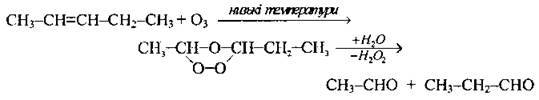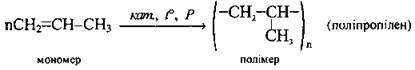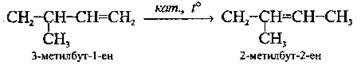Алкени (олефіни) – Речовини з подвійними зв’язками (алкени, алкадієни)
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ III. ОРГАНІЧНА ХІМІЯ
11. Вуглеводні
11.2. Речовини з подвійними зв’язками (алкени, алкадієни)
11.2.1. Алкени (олефіни)
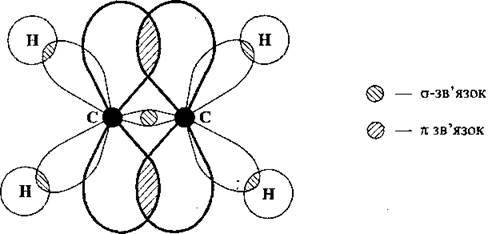
У молекулах алкенів є один подвійний зв’язок. Довжина зв’язку С=С в алкенах дорівнює 0,134 нм. Подвійний зв’язок – це зв’язок між двома атомами Карбону за допомогою двох електронних пар. Один із цих зв’язків – це дуже міцний о-зв’язок, а другий – менш міцний π (пі), який легко розривається
Номенклатура
1. Вибирають найдовший карбоновий ланцюг, який містить подвійний зв’язок:

2. Нумерацію починають з того кінця, до якого найближче розташований подвійний зв’язок (згідно з принципом найменших локантів):
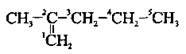
А) якщо в молекулі алкену подвійний зв’язок рівновіддалений від обох кінців карбонового ланцюга, то нумерацію починають з того кінця, до якого ближче розташований алкільний замісник:
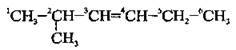
Б) при виборі нумерації користуються алфавітним порядком (етил → метил → пропіл):
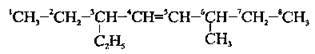
3. Назву сполуки становлять:
А) замісники, перераховані за абеткою, як і у випадку з алканами;
Б) назва алкену, яка відповідає головному карбоновому ланцюгу (корінь) + ближчий до початку локант подвійного зв’язку + суфікс – ен, які відділяють один від одного дефісами:
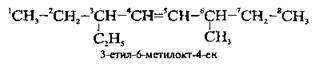
Фізичні властивості алкенів, гомологи та ізомери
Перші алкени С2Н4, С3Н6, С4Н8 – гази, С5Н10-С16Н32 – рідини, решта – тверді речовини. У воді практично не розчиняються або розчиняються погано. Усі алкени мають характерний запах.
Молекулярна формула алкену | Структурні формули алкенів | Назва алкену | |
Міжнародна | Тривіальна (традиційна) | ||
С2Н4 |
| Етен | Етилен1 |
С3Н6 |
| Пропен | Пропілен |
С4Н8 |
| Бут-1-ен | Бутилен |
| Бут-2-ен | ||
| 2-метилпропен |
1 За тривіальною назвою першого члена гомологічного ряду ці вуглеводні ще називають етиленовими.
Крім структурної та міжкласової ізомерії, етиленовим вуглеводням властивий ще один вид ізомерії – просторова (геометрична). Вона зумовлена розміщенням замісників щодо площини, в якій розташований подвійний зв’язок. Цей вид ізомерії спостерігається лише в тих випадках, коли кожний з атомів Карбону, сполучених подвійним зв’язком, використовує дві інші валентності на зв’язок з двома різними замісниками. Наприклад, ізомери бут-2-ену, в яких атоми або групи атомів розміщені в просторі по один бік від площини подвійного зв’язку, називають цис-ізомерами, а по різні боки – транс-ізомерами:
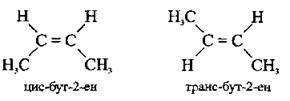
Для якісного виявлення алкенів (подвійного зв’язку) використовують дві реакції
1. Із бромною водою; під час пропускання алкену крізь бромну воду червоно-буре забарвлення зникає:
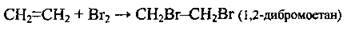
2. Окиснення алкенів водним розчином калій перманганату. При цьому фіолетове забарвлення розчину, зумовлене наявністю йонів МnО4-, зникає, оскільки КМnO4 окислює алкени до двохатомних спиртів (гліколів):
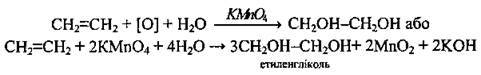
Добування алкенів
1. Крекінг насичених вуглеводнів, які містяться у нафті. Розрізняють:
А) термічний (t ≈ 600 ÷ 750 °С) крекінг;
Б) каталітичний крекінг (каталізатори: алюмосилікати, алюміній хлорид). Температура – близько 300 500 °С. Утворюється суміш алканів і алкенів:
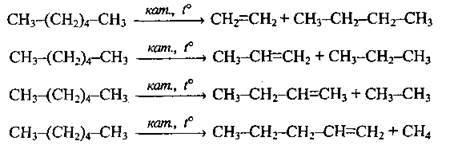
2. Дегідрування насичених вуглеводнів:
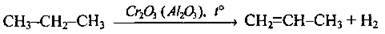
3. Відщеплення галогеноводнів від алкілгалогенідів (дегідрогалогенування):
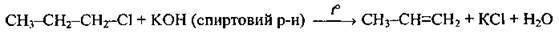
4. Відщеплення води від спиртів (дегідратація):
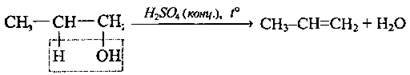
Дегідратація теж може відбуватися при використанні цинк хлориду як речовини, що забирає воду, а також при пропусканні парів спирту над алюміній оксидом (t ≈ 500 °С).
При написанні рівнянь реакції дегідратації спиртів і дегідрогалогенування керуємося правилом Зайцева1 : при відщепленні галогеноводнів від галогеноалканів чи води від спиртів атом Гідрогену відщеплюється від менш гідрогенізованого атома Карбону.
5. Відщеплення двох атомів галогенів від сусідніх атомів Карбону при дії цинку або міді (дегалогенування):
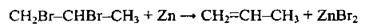
6. Часткове гідрування алкінів:
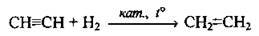
Хімічні властивості алкенів
Алкени більш реакційно здатні, ніж алкани. Це зумовлюється наявністю в їхніх молекулах подвійного зв’язку. Під дією різних реагентів (водню, води, галогенів, галогеноводнів) π-зв’язок слабший за σ-зв’язок, легко руйнується. Скориставшись електронними формулами, цей процес можна зобразити таким чином:

Вільні валентності атомів Карбону, які з’явились у результаті розриву π-зв’язку, використовуються для приєднання атомів чи груп атомів молекули реагента.
Приєднання (найхарактерніші реакції) | ||
| Гідрування (гідрогенізація). Кат. – Pt, Pd, Ni | |
| Галогенування | |
| Гідрогалогенування (за правилом Марковникова1) | |
| Гідратація (за правилом Марковникова) | |
Окиснення | ||
Горіння |
| Повне окиснення |
За м’яких умов без розриву С-С-зв’язків |
| Утворюються циклічні етери |
| Утворюється оцтовий альдегід | |
| Утворюється етиленгліколь (реакція Вагнера) | |
За жорстких умов з розривом С-С-зв’язку |
| Утворюються оцтова і пропіонова кислоти |
| Утворюються альдегіди: етаналь і пропаналь | |
Полімеризація2 | ||
| Індекс n – ступінь полімеризації | |
Ізомеризація | ||
| ||
1 Правило Марковникова: за приєднання несиметричного реагенту (ННаl, НОН) до несиметричного алкену атом Гідрогену реагенту приєднується до найбільш гідрогенізованого атома Карбону, що зв’язаний подвійним зв’язком.
2 Процес послідовного сполучення молекул низькомолекулярних речовин з утворенням високомолекулярних сполук називають полімеризацією.
Застосування етену та пропену
Серед органічних речовин найбільше у світі синтезується етену – 113 млн. т на рік (2008); і виробництво постійно нарощується зі швидкістю 2-3 % на рік. Відповідно збільшується і його застосування у сучасній промисловості:
– для виробництва полімерів (поліетилен (до 60 %) та ін.);
– для синтезу етилового спирту, етиленгліколю;
– для синтезу інших органічних речовин: оксирану (14-15 %), дихлороетану (12 %) та інших розчинників, вінілацетату, оцтової кислоти, етилбензену, стирену, діетилового етеру.
Цікаво, що етен (як фітогормон) може прискорювати достигання багатьох городніх і садових плодів (помідорів, динь, груш, лимонів тощо). Використовуючи цю властивість, плоди можна транспортувати ще зеленими, а потім доводити їх до стиглого стану вже на місці споживання, вводячи в повітря складських приміщень невеликі кількості етилену.
Пропілен, якого у світі виробляється більше 50 млн. т на рік, – важлива сировина нафтохімічної промисловості. Використовують у виробництві ізопропілового спирту, ацетону, акрилової кислоти й акрилнітрилу, поліпропілену, пластмас, каучуків, мастил, присадок і мийних засобів, компонентів пального, розчинників.
_____________________________________________________________________
1 Олександр Михайлович Зайцев (1841-1910) – російський хімік-органік, учень О. М. Бутлерова.