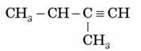Алкіни. Гомологічний ряд етину, загальна формула алкінів. Структурна ізомерія, номенклатура алкінів
І СЕМЕСТР
Тема 2. ВУГЛЕВОДНІ
Урок 14
Тема уроку. Алкіни. Гомологічний ряд етину, загальна формула алкінів. Структурна ізомерія, номенклатура алкінів
Цілі уроку: формувати в учнів знання про гомологічні ряди алкінів на прикладі ацетилену; ознайомити учнів з природою кратного зв’язку на прикладі потрійного зв’язку, новими видами ізомерії – ізомерією положення кратного зв’язку, міжкласовою ізомерією; розвивати навички й уміння складати структурні формули й називати органічні сполуки на прикладі гомологічного ряду
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: фронтальна робота, навчальна лекція, демонстраційний експеримент, робота з довідковою літературою.
Демонстрація 6. Одержання етину карбідним способом.
Обладнання: схема будови ацетилену, куле-стрижневі моделі ацетилену, фрагмент медіа-фільму “sp-гібридизація електронів у атомі Карбону”.
ХІД УРОКУ
I. Організація
II. Перевірка домашнього завдання.
Актуалізація опорних знань
1. Перевірка домашнього завдання біля дошки
2. Фронтальна бесіда
1) Сформулюйте головні положення теорії хімічної будови.
2) Що таке гібридизація? Що відбувається з електронними орбіталями атома Карбону в процесі sp2-гібридизації та sp-гібридизації?
3) Як відбивається наявність sp2-гібридизації на будові та властивостях алканів?
III. Вивчення нового матеріалу
1. Загальна характеристика ненасичених вуглеводнів
(Доповнюємо в процесі уроку порівняльну схему.)
Ацетиленовими вуглеводнями (алкінами) називаються ненасичені вуглеводні, що містять у молекулі один потрійний зв’язок і мають загальну формулу СnН2n-2. Родоначальником гомологічного ряду цих вуглеводнів є ацетилен НС 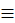 СН.
СН.
Характеристика | Алкани | Алкени | Алкіни |
Загальна формула | СnН2n+2 | СnН2n | СnН2n-2 |
Гомологічний ряд | СН4, С2Н6, С3Н8, С4Н10… | C2C4, С3Н6, С4Н8… | С2Н2, С3Н4, С4Н6… |
¦ Чому гомологічні ряди алкенів і алкінів починаються з вуглеводнів, що містять два атоми Карбону, а не один, як в алканів? (За загальною формулою виходять формули речовин CH2 і CH0, що не відповідає валентності Карбону.)
Пропонуємо учням фрагмент медіа-фільму про sp2-гібридизацію електронів і зв’язки в молекулах етану, етену й етину.
Атоми Карбону в молекулі ацетилену перебувають у стані sp-гібридизації. Це означає, що кожен атом Карбону має дві гібридні sp-орбіталі, осі яких розташовані на одній лінії під кутом 180° одна до одної, а дві p-орбіталі залишаються негібридними.

Sp-гібридні орбіталі двох атомів Карбону в стані, що передує утворенню потрійного зв’язку і зв’язків С-H
По одній із двох гібридних орбіталей кожного атома Карбону взаємно перекриваються, приводячи до утворення?-зв’язку між атомами Карбону. Кожна з решти гібридних орбіталей перекривається із s-орбіталлю атома Гідрогену, утворюючи?-зв’язок C-H.
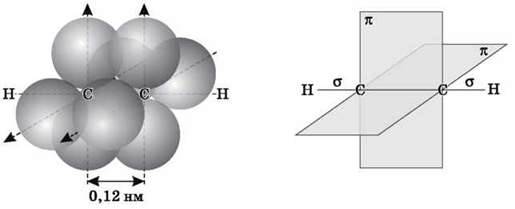
Схематичне зображення будови молекули ацетилену (ядра атомів Карбону й Гідрогену на одній прямій, два п-зв’язки між атомами Карбону перебувають у двох взаємно перпендикулярних площинах)
Дві негібридні p-орбіталі кожного атома Карбону, розташовані перпендикулярно одна одній і перпендикулярно напрямку?-зв’язків, взаємно перекриваються й утворюють два п-зв’язки. Отже, потрійний зв’язок характеризується сполученням одного? – і двох п-зв’язків.
Для алкінів характерними є всі реакції приєднання, властиві алкенам, однак у них після приєднання першої молекули реагенту залишається ще один п-зв’язок (алкін перетворюється на алкен), що може знову вступати в реакцію приєднання з іншою молекулою реагенту. Крім того, “незаміщені” алкіни проявляють кислотні властивості, зумовлені відщепленням протона від атома Карбону, що складає потрійний зв’язок (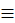 C-H).
C-H).
Завдання 1. Порівняйте будову молекул етану, етену й етину.
Вид гібридизації атома Карбону | Sp2-гібридизація: відбувається змішування однієї s – і двох р-орбіталей, а одна р-орбіталь залишається негібридизованою | Sp2-гібридизація: відбувається змішування однієї s – і двох р-орбіталей, а одна р-орбіталь залишається негібридизованою
| Sp-гібридизація: відбувається змішування однієї s – і однієї р-орбіталі, а дві р-орбіталі залишаються негібридизованими
|
Види зв’язків | C – H – ?-зв’язок; C – C – ?-зв’язок | C – H – ?-зв’язок; C = C – ? – і п-зв’язки | C – H – ?-зв’язок; C |
Довжина зв’язку | 0,154 нм | 0,133 нм | 0,120 нм |
Кут зв’язку | 109°’ 28′ | 120° | 180° |
Енергія зв’язку | 374,4 кДж/моль | 611,1 кДж/моль | 834,3 кДж/моль |
Завдання 2. Укажіть типи гібридизації атома Карбону в молекулі:
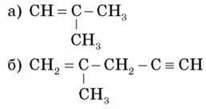
Запропонуйте види ізомерії, можливі в алкінів.
Види ізомерії | 1. Ізомерія карбонового скелета. |
2. Ізомерія положення С = С кратних зв’язків – вид ізомерії, за якої змінюється положення кратного зв’язку в головному ланцюзі | |
Номенклатура | 1. У головному ланцюзі обов’язково має перебувати кратний зв’язок. 2. Нумерація головного ланцюга починається з кінця, до якого ближче кратний зв’язок. 3. Положення кратного зв’язку вказується після назви вуглеводню |
Суфікс у назві головного ланцюга для алкінів – – ин(-ін) |
Для алкінів міжкласовими ізомерами будуть, наприклад, органічні сполуки, що містять два подвійні зв’язки. Запропонуйте структурні формули таких ізомерів для бутину й бутадієну.
Завдання 3. Складіть ізомери складу C5H8 і назвіть їх.
2. Фізичні й хімічні властивості алкінів
За фізичними властивостями алкіни нагадують алкени й алкани. Температури їх плавлення й кипіння збільшуються зі зростанням молекулярної маси. За звичайних умов алкіни C2 – C3 – гази, C4 – C16 – рідини, вищі алкіни – тверді речовини. Наявність потрійного зв’язку в ланцюзі приводить до підвищення температури кипіння, густини й розчинності їх у воді порівняно з олефінами й парафінами. Фізичні властивості деяких алкінів наведено в таблиці.
Фізичні властивості деяких алкінів
Назва | Формула | T°пл, °С | T°кип, °С |
Ацетилен | HC | -80,8 | -83,6 |
Метилацетилен | CH3 – C | -102,7 | -23,3 |
1-бутин | C2H5C | -122,5 | 8,5 |
2-бутин | CH3 – C | -32,3 | 27,0 |
1-пентин | CH3 – CH2 – CH2 – C | -98,0 | 39,7 |
2-пентин | CH3 – CH2 – C | -101,0 | 56,1 |
3-метил-1-бутин |
| – | 28,0 |
Заповнюємо порівняльну таблицю під керівництвом учителя.
Характеристика | Алкани | Алкени | Алкіни |
Фізичні властивості | C2H6 – етан | C2H4 – етилен | C2H2 – ацетилен |
Газ без запаху | Газ зі слабким запахом | Газ без запаху | |
Тпл = -182,8 °С | Тпл = -169,5 °С | Тпл = -80,8 °С (за тиску 170 кПа) | |
Ткип = -88,6 °С | Ткип = -103,8 °С | Ткип = -83,8 °С (сублімація) | |
Незначною мірою розчиняється у воді, краще – в органічних розчинниках | Незначною мірою розчиняється у воді, краще – в органічних розчинниках | Слабко розчиняється у воді, добре – в ацетоні під тиском |
IV. Первинне застосування одержаних знань
1. Тренувальні вправи
¦ Напишіть структурні формули речовин (по ланцюжку біля дошки):
А) 3-метил-1-пентин;
Б) 3-етил-4,4-диметил-1-пентин;
В) 2,2-диметил-3-гептин;
Г) 4-етил-4-метил-1-гексин;
Д) 3-етил-1-гексин;
Е) 2,2-дихлор-3-метил-1-бутин.
2. Самостійна робота під керівництвом учителя з наступною усною перевіркою
1) Дайте назви речовинам за структурними формулами:
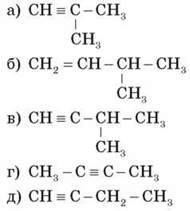
2) Складіть формули двох гомологів для речовини й назвіть їх:
CH  С – CH2 – CH3
С – CH2 – CH3
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання: підготувати повідомлення, схеми, презентації про застосування етину та його гомологів.