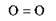Алотропія. Значення озонового шару для життя організмів на Землі
I СЕМЕСТР
Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (18 год.)
УРОК 6
Тема уроку. Алотропія. Значення озонового шару для життя організмів на Землі
Цілі уроку: ознайомити учнів з явищем алотропії; з’ясувати причини відмінностей властивостей алотропних модифікацій на прикладі алотропних видозмін Оксигену, Сульфуру, Карбону; формувати в учнів уявлення про залежність якісних і кількісних характеристик речовин на прикладі кисню й озону; показати роль озонового шару для життя мікроорганізмів на Землі, вплив діяльності людини на
Тип уроку: засвоєння нових знань.
Форми роботи: фронтальна бесіда з теми, навчальна лекція, робота з підручником.
Обладнання: періодична система хімічних елементів, таблиця розчинності, моделі кристалічних граток алмаза, графіту, схема будови моноклінної та ромбічної сірки, фулеренів, таблиця порівняння властивостей алотропних модифікацій.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання,
Мотивація навчальної діяльності
Заслуховуємо повідомлення учнів про природні сполуки Оксигену, Сульфуру, Карбону, Силіцію. Особливу
Як можна пояснити відмінності в зовнішньому вигляді й фізичних властивостях цих речовин?
Далі дізнаємося, що вони відрізняються й хімічними властивостями. Ці відмінності пояснюються різною будовою речовини.
У 7 класі ми вивчали дві прості речовини, утворені Оксигеном, – кисень і озон.
Чим вони відрізняються? (Кількістю атомів Оксигену)
Порівняймо фізичні властивості кисню й озону (з допомогою підручника або інших довідкових матеріалів).
Кисень | Озон | |
Хімічна формула | О2 | О3 |
Молярна маса | 32 | 48 |
Будова |
|
|
Агрегатний стан | Газ | Газ |
Колір | Відсутній | Синій |
Запах | Відсутній | Різкий |
Температура кипіння, °С | -183,0 | -111,9 |
Температура плавлення, °С | -218,7 | -192,7 |
Явище, за якого той самий хімічний елемент утворює кілька простих речовин, називається алотропією (від грецьк. “мінливість”).
ІІІ. Вивчення нового матеріалу
Явище алотропії (розповідь учителя)
Прості речовини, утворені тим самим елементом, називаються алотропними видозмінами цього елемента.
Алотропія спостерігається в багатьох елементів. Вона пояснюється наявністю двох і більше молекул, що містять різну кількість атомів (S2, S8), або наявністю двох і більше кристалічних форм, що характеризуються різним розташуванням атомів у кристалічних гратках.
1) Алотропія Оксигену
Кисень – безбарвний газ, без запаху. молекула – O2. Будова:  .
.
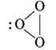
Парамагнітний (притягується магнітом, має два неспарені електрони). Алотропна модифікація – озон O3:

Озон відрізняється від кисню кількістю атомів у молекулі й різко відрізняється від кисню за фізичними й хімічними властивостями.
Озон – це газ синього кольору з різким дратівним запахом. Назва походить від грецького слова озейн – “запах”. Токсичний, tкип = -111,9 °С (для порівняння: у кисню tкип = -183,0 °С), інтенсивне забарвлення і краща, ніж у кисню, розчинність.
У природі озон утворюється з кисню під час грозових розрядів, а на висоті 10-30 км – під дією ультрафіолетового випромінювання. Він затримує шкідливе для людини ультрафіолетове випромінювання Сонця, поглинає інфрачервоні промені Землі, перешкоджаючи її остиганню.
Утворення O3 – ланцюгова реакція:
O2 + hv  O2* – активна частинка
O2* – активна частинка
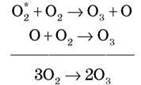
Молекула O3 нестійка й за значної концентрації розпадається з вибухом.
3O3  3O2
3O2
Окисна здатність озону вища, ніж кисню. За нормальних умов він окислює срібло та ртуть:
8Ag + 2O3  4Ag2O + O2
4Ag2O + O2
Озон використовують для очищення питної води, дезінфекції повітря. Повітря хвойних лісів корисне, тому що озон утворюється в процесі окиснення смоли хвойних дерев.
Відома ще одна модифікація Оксигену – O4.
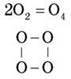
[O4 ] (н. у.) – близько 0,1 % у рідкому й до 0,05 % у твердому кисні. Рідкий і твердий кисень, на відміну від газоподібного, забарвлений у синій колір.
2) Алотропія Сульфуру (заповнення опорної схеми)
Природна сірка – порошок жовтого кольору. Сульфур має кілька алотропних модифікацій, які відрізняються будовою кристалічних граток. ромбічна й моноклінна сірка складаються з восьмиатомних кільцеподібних молекул S8. Відмінності у властивостях пояснюються не кількістю атомів, а різною структурою кристалів. ромбічна сірка – жовта, моноклінна – блідо-жовтого кольору. Шари циклічних молекул пов’язані між собою.
Третя модифікація – пластична сірка. Вона складається із зигзагоподібних ланцюжків Sn, де n – до кількох тисяч.
Розрізняють також модифікації Сульфуру – S2 (пурпурна) і S6 (оранжево-жовта).
Як правило, з усіх алотропних видозмін хімічного елемента за певних умов стійкою є лише одна.
Для Сульфуру за нормального тиску й t° < 95,6 °С стійкою є ромбічна модифікація. За кімнатної температури на неї перетворюються решта форм. У процесі кристалізації з розплаву сірки спочатку утворюються голчасті кристали моноклінної сірки, які за температури нижче 95,6 °С переходять у ромбічні.
За температури вище 95,6 °С стійкою є моноклінна сірка, за температури плавлення сірка – рухлива жовта рідина. У результаті подальшого нагрівання вона буріє, втрачаючи рухливість. Якщо вилити її в холодну воду (швидке охолодження), утвориться еластична, схожа на гуму коричнева маса – пластична сірка.
Sкр  Sпласт – Q (кДж)
Sпласт – Q (кДж)
У нерозтягнутій сірці ланцюжки переплутані, скручені, унаслідок розтягування вони розправляються паралельно один одному. Пластична сірка нестійка, поступово переходить у ромбічну, жовтіє.
За значного нагрівання сірка переходить у пару бурого кольору (S2, S4, S8), за температури понад 1 760 °С сірка одноатомна.
3) Алотропія Фосфору
Продовжимо вивчення явища алотропії на прикладі сполук Фосфору.
У вільному стані існує кілька алотропних видозмін. У парі – це молекули правильної тетраедричної форми P4. Унаслідок охолодження пара переходить у білу форму, утворену молекулами Р4 (? = 1,8 г/см3, Тпл = 44 °С). У воді білий фосфор не розчиняється. Зберігають його під шаром води в темряві, тому що він леткий. Кристалічна гратка – молекулярна. Надзвичайно отруйний! Розчиняється в багатьох органічних розчинниках. У разі зберігання на світлі, за незначного нагрівання без доступу повітря переходить у порошок червоного кольору:
Рбілий  Рчервоний + 4 ккал
Рчервоний + 4 ккал
Процес прискорюється в результаті нагрівання під дією світла, у присутності слідів іоду.
Практично червоний фосфор одержують шляхом тривалого нагрівання білого фосфору до температури 280-340 °С. Це порошок, ? = 2,3 г/см3, не розчинний у воді. Не леткий, не отруйний. Використовується в сірниковому виробництві:
6P (коробок) + 5КСlО3 – 3Р2О5 + 5KCl
Запалюється під час горіння. Пара червоного фосфору, конденсуючись, перетворюється на білий фосфор.
Білий фосфор активніший за червоний: окислюється навіть за низьких температур і запалюється за температури 50 °С, червоний майже не окислюється. Інші реакції з білим фосфором також протікають більш енергійно.
Витримуванням білого фосфору за температури 220 °С і тиску 12 тис. атм можна одержати чорний фосфор (? = 2,7 г/см3). Чорний фосфор має шарувату структуру й за зовнішнім виглядом схожий на графіт, напівпровідник, а за хімічними властивостями подібний до червоного фосфору. Під тиском 18 тис. атм плавиться за температури близько 400 °С, а під тиском своєї пари переходить у фіолетовий. За тиску понад 111 тис. атм – металева фаза фосфору.
4) Алотропні модифікації Карбону
Карбон утворює дві найбільш відомі модифікації – алмаз і графіт. Відомий також карбін. Аморфний вуглець – деревне вугілля, сажа.
Характеристика основних алотропних модифікацій Карбону
Алмаз. ? = 3,5 г/см3, найтвердіший з усіх мінералів. Чисті алмази – безбарвні та прозорі. (Розглядаємо модель кристалічної гратки алмаза.)
Утворення природних алмазів відбувалося шляхом кристалізації С у глибинних шарах Землі (200-300 км від поверхні), t° = 3 000 °С, Р = 200 тис. атм. їх родовища пов’язані з рідкісними виходами на поверхню особливої гірської породи – кімберліту. Промислові розробки містять близько 0,5 г алмаза на 1 т породи (Якутія, Південна Африка).
Кожен атом Карбону в алмазі з’єднаний з чотирма іншими ковалентним неполярним зв’язком, причому відстані від його центра до центра інших атомів однакові (1,54 А). Відносно кожного атома Карбону чотири сусідні перебувають у кутах правильного тетраедра. Гратка алмаза – атомна (демонстрація кристалічної гратки). Чотири однакові електронні хмари спрямовані до вершин тетраедра.
Алмаз крихкий і розколюється від удару. Проводить тепло, але не проводить електричного струму.
Не діють на алмаз кислоти й луги. На повітрі горить за температури 900 °С, а за t° ? 1 200 °С за відсутності повітря графітується.
Графіт. Сіра, жирна на дотик, з металевим блиском маса, ? = 2,2 г/см3, м’який, легко дряпається нігтем і після тертя ним об папір залишає сірі смуги.
Кристал графіту побудований із плоских сіток атомів Карбону, що розташовуються один над одним. (Розглядаємо модель кристалічної гратки графіту.)
Кожен атом Карбону з’єднаний трьома ковалентними зв’язками з трьома іншими атомами (1,42 А – міцний зв’язок). Відстань між шарами – 3,35 А (зв’язок слабший), тому розщеплюється на лусочки в разі механічного впливу (tпл = 4 492 °С за Р = 10 атм).
Четвертий валентний електрон утворює слабкі металеві зв’язки між шарами.
Добре проводить тепло, має близьку до металів електропровідність.
Перехід “алмаз  графіт
графіт  алмаз” можна здійснити лише за високих тисків, високих температур і наявності каталізатора.
алмаз” можна здійснити лише за високих тисків, високих температур і наявності каталізатора.
Аморфні модифікації Карбону
Деревне вугілля утворюється в результаті нагрівання деревини без доступу повітря. Рихлий чорний продукт, зберігає структуру деревини.
Тваринне вугілля утворюється в результаті обвуглювання тваринних тканин.
Сажа – продукт неповного згоряння органічних сполук.
5) Значення озонового шару Землі. Вплив людини на озоновий шар
Озонова діра, всупереч своїй назві, – це не пролом в атмосфері. В атмосфері озон сконцентрований у так званому озоновому шарі, розташованому на висоті близько 30 км у межах стратосфери. У цьому шарі відбувається поглинання ультрафіолетового випромінювання Сонця, інакше сонячна радіація могла б завдати великої шкоди життю на поверхні Землі. Будь-яка загроза озоновому шару заслуговує на серйозне ставлення. У 1985 році британські вчені, які працювали на Південному полюсі, виявили, що під час антарктичної весни рівень озону в атмосфері там значно нижчий за норму. Щорічно в той самий час кількість озону зменшувалася – іноді більшою мірою, іноді меншою. Подібні, але не настільки яскраво виражені, озонові діри з’являлися також над Північним полюсом – під час арктичної весни.
Упродовж наступних років учені з’ясували, чому з’являється озонова діра. Коли сонце ховається й починається довга полярна ніч, відбувається різкий спад температури й утворюються високі стратосферні хмари, що містять кристалики льоду. Поява цих кристаликів спричиняє серію складних хімічних реакцій, які приводять до накопичення молекулярного хлору (молекула хлору складається з двох з’єднаних атомів Хлору). Коли з’являється сонце й починається антарктична весна, під дією ультрафіолетових променів відбувається розрив внутрішньо-молекулярних зв’язків і в атмосферу спрямовується потік атомів Хлору. Ці атоми виступають у ролі каталізаторів реакцій перетворення озону на простий кисень, що протікають за такою подвійною схемою:
Cl + О3  СlО + О2
СlО + О2
СlО + О  Cl + О2
Cl + О2
У результаті цих реакцій молекули озону (О3) перетворюються на молекули кисню (О2), причому вихідні атоми Хлору залишаються у вільному стані та знову беруть участь у цьому процесі (кожна молекула Хлору руйнує мільйон молекул озону до того, як вони вийдуть з атмосфери під дією інших хімічних реакцій). Унаслідок цього ланцюжка перетворень озон починає зникати з атмосфери над Антарктидою, утворюючи озонову діру. Однак незабаром, після потепління, антарктичні вихрі руйнуються, свіже повітря (що містить новий озон) спрямовується в цей район, і діра зникає.
У 1987 році в Монреалі відбулася Міжнародна конференція, присвячена загрозі озоновому шару, і промислово розвинені країни домовилися про скорочення та, врешті-решт, про припинення виробництва хлорованих і флуорованих вуглеводнів (хлорфлуор-карбонів, ХФК) – хімічних речовин, що руйнують озоновий шар. Сьогодні вчені вважають, що приблизно через п’ятдесят років озоновий шар відновиться остаточно.
IV. Підбиття підсумків уроку
Фронтальна бесіда за запитаннями
1) У чому полягають відмінності між алотропними модифікаціями Оксигену? Карбону?
2) Як пояснити різку відмінність фізичних і хімічних властивостей алотропних модифікацій Оксигену? Карбону?
3) Яке значення має озоновий шар Землі для живих організмів?
4) Чим відрізняються алотропні модифікації й аморфні речовини, утворені тим самим хімічним елементом?
5) Одержання штучних алмазів із графіту – це явище фізичне чи хімічне? Чому?
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.