Аміак – Елементи VA групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
9.4. Елементи VA групи
9.4.3. Аміак
Аміак (амоніак) – одна з найважливіших сполук Нітрогену.
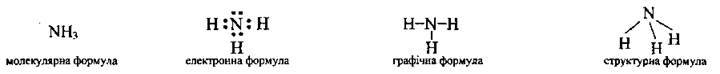
Молекула з чотирма гібридизованими sр3-орбіталями має форму майже правильного тетраедра, валентні кути (H-N-H) – 107,8°. У центрі розташований атом Нітрогену, вершину утворює одна гібридизована sр3-орбіталь з неподіленою парою електронів, а в кутах основи (правильного
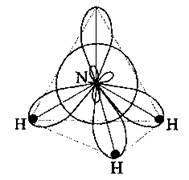
У молекулі аміаку є три дуже полярні ковалентні сигма-зв’язки. Спільні електронні пари сильно зміщені в бік атома Нітрогену, оскільки його електронегативність набагато більша за електронегативність атома Гідрогену. Наявність трьох ковалентних зв’язків зумовлює валентність Нітрогену – III. За певних умов валентність Нітрогену може збільшитися до IV за рахунок утворення четвертої ковалентної пари за донорно-акцепторним механізмом:
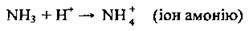
Фізичні властивості та фізіологічна дія аміаку
За стандартних
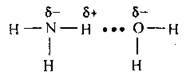
Аміак – надзвичайно токсична речовина (задушливої та нейротропної дії). Він спричиняє дуже подразнює слизові, шкіру (хімічний опік), набряк легень та важке ураження нервової системи. Через швидке випаровування при контакті зі шкірою рідкий аміак та його розчини можуть призвести до обморожування.
Добування аміаку
У лабораторії аміак добувають нагріванням солей амонію з лугами:
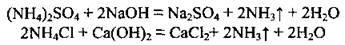
Оскільки аміак легший за повітря, його збирають у посудину, перевернуту догори дном.
У промисловості аміак добувають взаємодією азоту з воднем. Реакцію здійснюють за температури 450-500 °С і тиску 200-300 атм., каталізатор – Fe з домішками К2O, Аl2O3:
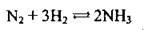
Необхідний для реакції азот добувають з повітря, а водень – конверсією метану з водяною парою:
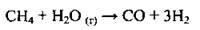
Хімічні властивості аміаку
Аміак має основні властивості, які виявляються в реакціях з водою та кислотами:
А) з водою:
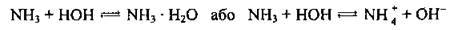
Утворюється нашатирний спирт. Наявність гідроксид-іонів зумовлює лужне середовище. Установлено, що за стандартних умов у реакцію вступає не більше 1 % розчиненого аміаку;
Б) з кислотами (утворюються солі амонію):
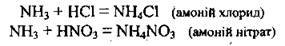
При взаємодії аміаку з багатоосновними кислотами можуть утворюватись і кислі солі:
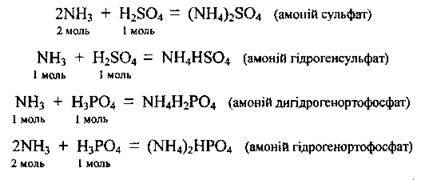
Відновні властивості аміаку пояснюються тим, що Нітроген у молекулі аміаку має найнижчий ступінь окиснення (-3). Тому аміак може бути відновником (утворюється N2 або NO):
А) аміак горить (зеленуватим полум’ям) лише в атмосфері кисню:
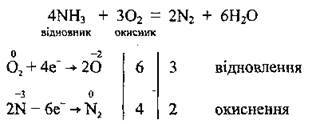
Якщо ж реакція відбувається за наявності каталізатора (Pt), то утворюється не азот, а нітроген(ІІ) оксид. Цю реакцію називають каталітичним окисненням аміаку:
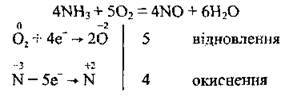
Б) аміак реагує і з іншими окисниками:
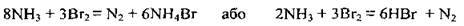
В) аміак відновлює деякі метали з оксидів відповідних металічних елементів:
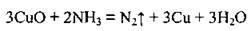
Застосування аміаку
Аміак широко використовують у різних галузях промисловості, у медицині, техніці, сільському господарстві:
– для добування нітратної кислоти, добування соди (аміачний метод), вибухових речовин, для синтезу пластмас і штучних волокон (капрону);
– у виробництві мінеральних добрив (нітратів, амоній сульфату, сечовини (NH2)2CO);
– як холодагент у промислових холодильниках.
Аміак входить до складу мийних засобів для прання білизни, чищення скла, килимів і ювелірних виробів; рідкий аміак використовують як розчинник.
Нашатирний спирт застосовують у медицині, для збудження дихання в непритомному стані (стимуляція дихального і судинорухового центрів головного мозку)2.
________________________________________________________________
1 Назву “нашатирний спирт” не слід плутати з терміном “нашатир” – тривіальною назвою амоній хлориду.
2 Піднісши до ніздрів шматочок вати, змоченої нашатирним спиртом.