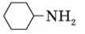Аміни, їхній склад, хімічна, електронна будова, класифікація. Аміни як органічні основи. Взаємодія амінів з водою й кислотами, горіння
II Семестр
Тема 5. НІТРОГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ
Урок 50
Тема уроку. Аміни, їхній склад, хімічна, електронна будова, класифікація. Аміни як органічні основи. Взаємодія амінів з водою й кислотами, горіння
Цілі уроку: розширити знання учнів про різноманіття органічних сполук на прикладі нітрогеновмісних сполук; ознайомити з класифікацією амінів, їхніми фізичними й хімічними властивостями; дати уявлення про будову молекул амінів, їх гомологію, ізомерію, номенклатуру; показати поширення амінів у природі, їхню біологічну роль,
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: евристична бесіда, навчальна лекція.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання.
Актуалізація опорних знань
1. Розповідь учителя
В органічних сполуках Нітроген міститься:
– у структурі карбонового ланцюга;
– у складі функціональних груп (наприклад, нітрогрупи, аміногрупи).
Відомо безліч природних і синтетичних органічних сполук, що містять
У цій темі ми розглянемо важливі нітрогеновмісні сполуки – аміни (R – NH2).
Щоб краще зрозуміти будову і властивості цих сполук, необхідно згадати електронну будову атома Нітрогену й дати характеристики його хімічним зв’язкам з іншими атомами (Гідрогеном, Карбоном, Оксигеном).
2. Учні біля дошки зображують схему будови атома Нітрогену.
III. Вивчення нового матеріалу
1. Аміни
Аміни – похідні амоніаку, що утворюються в результаті заміщення атомів Гідрогену на вуглеводневі радикали.
Залежно від числа радикалів розрізняють аміни:
– первинні (R – NH2);
– вторинні (R – NH – R’);
– третинні 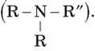
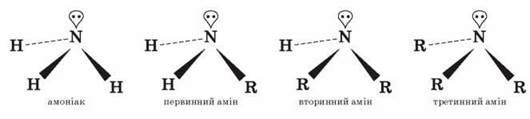
Атом Нітрогену в NH3 і амінах перебуває в стані sp3-гібридизації. Три такі орбіталі перекриваються з 1s-орбіталями атомів Гідрогену або sp3-орбіталями атома Карбону радикала й утворюють три?-зв’язки, а четверта sp3-орбіталь виявляється зайнятою вільною електронною парою атома Нітрогену.
Номенклатура
Складаючи назву, перелічують радикали з додаванням закінчення – амін:
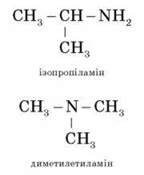
Ізомерія
1) Ізомерія карбонового скелета (починаючи з бутиламіну).
2) Ізомерія положення аміногрупи (починаючи з пропіламіну).
2. Фізичні властивості
За звичайної температури лише нижчі аліфатичні аміни CH3NH2, (CH3)2NH і (CH3)3N – гази (із запахом амоніаку), середні гомологи – рідини (з різким рибним запахом), вищі – тверді речовини без запаху. Ароматичні аміни – безбарвні рідини з високою температурою кипіння або тверді речовини. Нижчі аміни добре розчинні у воді й мають різкий запах. Зі збільшенням молекулярної маси збільшуються температури кипіння і плавлення, зменшується розчинність у воді.
Фізичні властивості деяких амінів наведено в таблиці.
Фізичні властивості деяких амінів
Назва аміну | Формула | D420 | T°пл, °С | T°кип, °С | Kb (H2O, 25 °С) |
Амоніак | NH3 | 0,68 у рідкому стані | -77,7 | -33 | 1,8-10-5 |
Метиламін | CH3 – NH2 | 0,66 у рідкому стані | -92,5 | -6,5 | 4,4-10-4 |
Етиламін | CH3 – CH2 – NH2 | 0,68 | -81,5 | +16,5 | 5,6-10-4 |
Диметиламін | CH3 – NH – CH3 | 0,68 | -96 | +7,4 | 9,0-10-4 |
Пропіламін | CH3 – CH2 – CH2 – NH2 | 0,72 | -83 | +50 | 5,7-10-4 |
Діетиламін | (CH3 – CH2)2NH | 0,70 | -50 | +55,5 | 9,6-10-4 |
Триетиламін | (CH3 – CH2)3N | 0,71 | -115 | +89,5 | 4,4-10-4 |
Циклогексиламін |
| 0,87 | -18 | +134 | 4,4-10-4 |
Етилендіамін | H2N – CH2 – CH2 – NH2 | 0,90 | +8,5 | +116 | 8,5-10-5 |
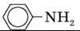
Анілін |
| 1,02 | -6 | +184 | 3,8-10-10 |
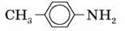
N-толуїдин |
| 1,05 | +44 | +200 | 1,4-10-9 |
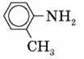
О-толуїдин |
| 0,99 | -24 | +200 | 2,4-10-10 |
М-толуїдин |
| 0,99 | -31 | +203 | 4,9-10-10 |
N-нітроанілін |
| 1,48 | +147,5 | +331 | 1,3-10-12 |
Зв’язок N – H є полярним, тому первинні та вторинні аміни утворюють міжмолекулярні водневі зв’язки (трохи більш слабкі, ніж Н-зв’язки за участі групи O – H).
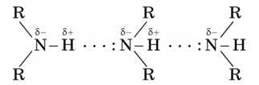
Асоціації амінів
Це пояснює відносно високу температуру кипіння амінів порівняно з неполярними сполуками з подібною молекулярною масою. Наприклад:
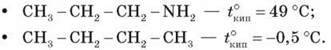
Третинні аміни не утворюють водневих зв’язків, що створюють асоціації (відсутня група N – H). Тому їхні температури кипіння нижчі, ніж в ізомерних первинних і вторинних амінів (триетиламін кипить за температури 89 °С, а н-гексиламін – за 133 °С).
Порівняно зі спиртами аліфатичні аміни мають нижчі температури кипіння (t°кип метиламіну – -6 °С, t°кип метанолу – +64,5 °С). Це свідчить про те, що аміни асоційовані меншою мірою, ніж спирти, оскільки міцність водневих зв’язків з атомом Нітрогену менша, ніж за участі більш електронегативного Оксигену.
Аміни здатні до утворення водневих зв’язків з водою:
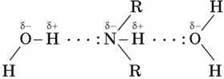
Гідратація амінів
Завдяки цій особливості нижчі аміни добре розчиняються у воді. Зі збільшенням числа й розмірів вуглеводневих радикалів розчинність амінів у воді зменшується, тому що збільшуються просторові перешкоди утворенню водневих зв’язків. Ароматичні аміни у воді практично не розчиняються.
3. Хімічні властивості амінів
1) Горіння
Аміни згоряють у кисні, утворюючи азот, вуглекислий газ і воду.
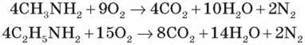
Оскільки аміни є похідними амоніаку й мають подібну з ним будову, вони проявляють властивості, подібні до його властивостей.
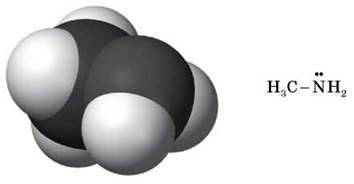
Моделі молекул
Як в амоніаку, так і в амінах атом Нітрогену має неподілену пару електронів:
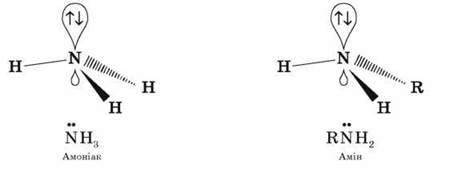
Тож аміни, подібно до амоніаку, проявляють властивості основ.
2) Властивості амінів як основ (акцепторів протонів)
Водні розчини аліфатичних амінів дають лужну реакцію, тому що внаслідок їх взаємодії з водою утворюються гідроксиди алкіламонію, аналогічні амоній гідроксиду:
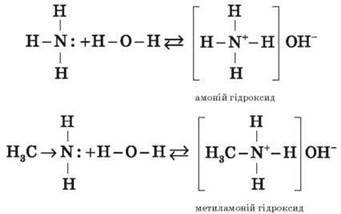
Зв’язок протона з аміном, як і з амоніаком, утворюється за донорно-акцепторним механізмом за рахунок неподіленої електронної пари атома Нітрогену.
Аліфатичні аміни – сильніші основи, ніж амоніак, оскільки алкільні радикали збільшують електронну густину на атомі Нітрогену. З цієї причини електронна пара атома Нітрогену утримується менш міцно й легше взаємодіє з протоном.
3) Взаємодія з кислотами
Взаємодіючи з кислотами, аміни утворюють солі:
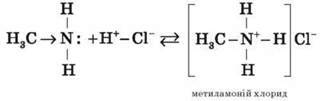
Солі амінів – тверді речовини, добре розчинні у воді. Унаслідок нагрівання лугу витісняють із них аміни:
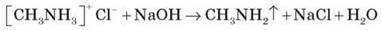
Отже, головні властивості змінюються в ряду:
NH3 < RNH2 < R2NH < R3N (у газовій фазі)
4) Окиснення амінів
Аміни, особливо ароматичні, легко окислюються на повітрі. На відміну від амоніаку, вони здатні запалюватися від відкритого полум’я.
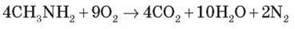
4. Застосування амінів
Аміни використовують для одержання лікарських речовин, барвників і вихідних продуктів для органічного синтезу. Гексаметилендіамін у процесі поліконденсації з адипіновою кислотою дає поліамідні волокна.
IV. Первинне застосування одержаних знань
Учнів працюють по ланцюжку біля дошки.
1) Напишіть структурні формули можливих ізомерів складу C5H13N, C6H15N і назвіть їх.
2) Запишіть реакцію горіння одного з ізомерів.
3) Запишіть рівняння реакції взаємодії одного з ізомерів з гідроген хлоридом.
4) Обчисліть об’єм метиламіну, що містить 4 % домішок, якщо внаслідок його спалювання виділився азот об’ємом 4,9 л (н. у.).
5) Запишіть рівняння реакцій для здійснення перетворень:
CH2 = CH2 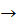 A
A 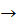 CH3 – CH2 – NO2
CH3 – CH2 – NO2 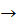 Б
Б 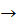 (С2H5)2NH
(С2H5)2NH
Розшифруйте речовини А і Б.
V. Підбиття підсумків уроку
Підбиваємо підсумки уроку, оцінюємо роботу учнів на уроці.
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання: з курсу біології згадати матеріал про біологічну роль амінів, їх поширення в природі й застосування, підготувати його у формі презентації, схеми, колажу тощо.