Амоніак: властивості, використання. Солі амонію. Якісна реакція на іон амонію
I СЕМЕСТР
Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (18 год.)
УРОК 9
Тема уроку. Амоніак: властивості, використання. Солі амонію. Якісна реакція на іон амонію
Цілі уроку: ознайомити зі складом, особливостями будови молекули й фізичними властивостями амоніаку, розчинністю амоніаку у воді й дією індикаторів на розчин, особливостями взаємодії амоніаку з водою й кислотами; формувати вміння складати іонно-молекулярні рівняння реакції на прикладі властивостей амоніаку; розповісти про застосування амоніаку; розширити уявлення про
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: навчальна лекція, лабораторний і демонстраційний експерименти, робота з опорною схемою.
Обладнання:
Демонстрація. Одержання амоній хлориду (“дим без вогню”).
Лабораторний дослід 2. Визначення іонів амонію в розчині.
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань, перевірка домашнього завдання
1. Напишіть рівняння одержання амоніаку, укажіть окисник і відновник.
2. Охарактеризуйте цю реакцію, назвіть умови, необхідні для перебігу цієї реакції.
III. Вивчення нового матеріалу (розповідь учителя)
1. Амоніак – будова молекули й фізичні властивості
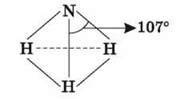
Молекула NH3 має структуру трикутної піраміди з атомом Нітрогену у вершині. Хімічний зв’язок утворюється шляхом
Перекривання s-орбіталей трьох атомів Гідрогену і трьох р-орбіталей Нітрогену. р-хмари перпендикулярні, але кут між зв’язками перевищує 90°, тому що електронні хмари атомів Гідрогену відштовхуються й утворюють кут зв’язку 107°. Довжина зв’язку N – H становить 1,01 А.
Фізичні властивості: безбарвний газ із різким запахом, добре розчинний у воді (до 700 л амоніаку в 1 л води). Температура плавлення дорівнює -77,7 °С, температура кипіння 33,4 °С.
2. Хімічні властивості амоніаку
1) Окиснення для молекули амоніаку є мало-характерним, оскільки молекула амоніаку стійка.
А) На повітрі не горить, але в атмосфері кисню згоряє жовтим полум’ям:
4NH3 + 3О2  6H2О + 2N2 + 303 ккал
6H2О + 2N2 + 303 ккал
Зверніть увагу на те, що суміш амоніаку й кисню внаслідок нагрівання може вибухати!
Б) Неповне окиснення в присутності каталізатора (kat – Pt, Fe2О3, Cr2О3):
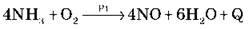
Тут каталізатор не лише прискорює, але і змінює напрям реакції.
2) Для амоніаку характерні реакції приєднання з утворенням іона амонію.
А) Взаємодія з водою:
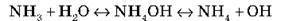
Утворюється ковалентний зв’язок за донорно-акцепторним механізмом:
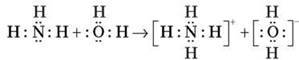
У розчині амоніаку індикатори змінюють колір: лакмус – на синій, фенолфталеїн – на малиновий, що вказує на лужне середовище розчину амоніаку.
Іон NH4+ має форму правильного тетраедра, усі зв’язки – ковалентні полярні, рівноцінні (мають однакову довжину й кут зв’язку).
Б) Приєднання кислот:
NH3 + HCl  NH4Cl
NH4Cl
За цілковитої відсутності води реакція не протікає:
NH4ОH + HCl  NH4Cl + H2О
NH4Cl + H2О
Висновок: розчин амоніаку NH3 – основа, оскільки взаємодіє з кислотами, а розчин має лужну реакцію.
IV. Первинне застосування отриманих знань
1. Напишіть рівняння реакцій, з допомогою яких можна здійснити перетворення:
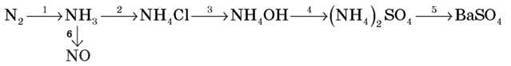
Укажіть, як змінюється ступінь окиснення Нітрогену в 1-й і 6-й реакціях.
2. Демонстрація досліду “Дим без вогню”. Особливості взаємодії амоніаку з хлоридною кислотою:
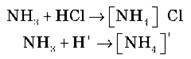
3. Запишіть рівняння взаємодії амоніаку із сульфатною кислотою в молекулярній та іонній формах:
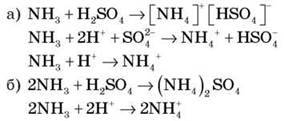
Висновок: NH+ можна розглядати у формулах як іон одновалентного металу.
4. Якісною реакцією на іон амонію є реакція взаємодії з лугами. При цьому утворюється слабка основа NH4OH, що легко розкладається на амоніак і воду, при цьому з’являється запах амоніаку. Усі солі й розчини, що містять іон амонію, мають слабкий запах амоніаку.
Лабораторний дослід 5. Якісна реакція на іон амонію
Здійсніть якісну реакцію й визначте наявність у розчині іона амонію, запишіть іонно-молекулярне рівняння взаємодії амоній хлориду з лугами:
NH4Cl + KOH  KCl + NH4ОH
KCl + NH4ОH  KCl + NH3 + H2О
KCl + NH3 + H2О
NH4+ + Cl – + K+ + OH –  K+ + Cl – + NH3 + H2О
K+ + Cl – + NH3 + H2О
NH4+ + OH –  NH3 + H2О
NH3 + H2О
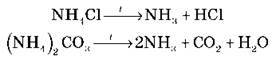
5. Назвіть способи одержання солей амонію. Термічний розклад солей амонію супроводжується появою запаху амоніаку:
V. Самостійна робота
Завдання 1. Складіть повні та скорочені іонні рівняння реакцій між речовинами.
Варіант І
А) амоній гідроксид і ортофосфатна кислота;
Б) амоній сульфат і кальцій гідроксид.
Варіант ІІ
А) магній хлорид і амоній фосфат;
Б) амоній нітрат і калій гідроксид.
Завдання 2. Напишіть рівняння окисно-відновної реакції одержання речовин.
Варіант І: нітроген(ІІ) оксид.
Варіант ІІ: амоніак.
Укажіть умови зміщення хімічної рівноваги в цих реакціях у бік утворення продукту реакції.
Завдання 3. Поясніть механізм утворення іона амонію NH4+ у реакціях.
Варіант І: розчинення амоніаку у воді.
Варіант ІІ: взаємодії амоніаку з хлоридною кислотою.
VI. Підбиття підсумків уроку
VII. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.