БІЛКИ – Органічні речовини
Біологія. Експерес-підготовка до ЗНО та ДПА
ТЕОРЕТИЧНІ ВІДОМОСТІ
РОЗДІЛ І. МОЛЕКУЛЯРНИЙ РІВЕНЬ ОРГАНІЗАЦІЇ ЖИТТЯ
Тема 2. Органічні речовини
БІЛКИ
Білки – високомолекулярні нерегулярні гетерополімери, мономерами яких є амінокислоти. До складу білків входять 20 різних амінокислот.
Амінокислоти – структурні мономери білків

Амінокислоти сполучаються між собою ковалентним зв’язком між карбоксильною групою однієї амінокислоти та аміногрупою іншої. Такий зв’язок називається пептидним.
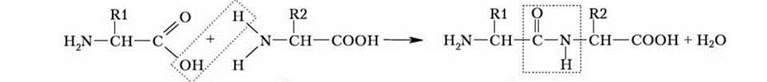
Схема утворення пептидного зв’язку
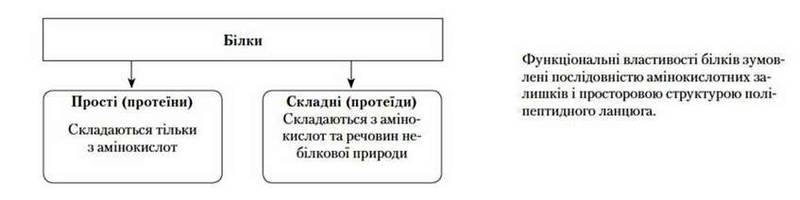
Види білків (за складом)
Просторова структура білків

Порушення природної структури білків
Під впливом різних фізико-хімічних чинників (дія концентрованих кислот і лугів, важких металів, високої температури тощо) структура та властивості білків можуть змінюватися.
Процес порушення природної структури білка або розгортання поліпептидного ланцюга без руйнування пептидних зв’язків
Денатурація має необоротний характер. Однак на перших стадіях, за умов припинення дії негативних чинників, білок може відновлювати свій нормальний стан (ренатурація).
Процес руйнування первинної структури білків завжди необоротний, він називається деструкцією.
Функції білків
Функція | Характеристика |
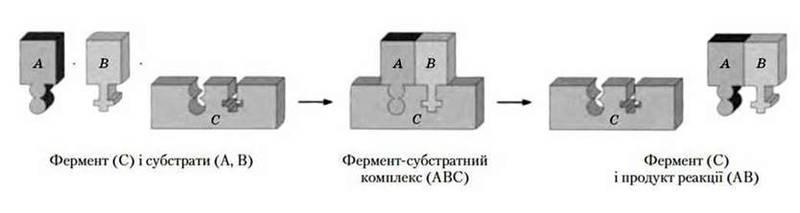
Ферментативна (біокаталіз) | Ферменти забезпечують перебіг хімічних реакцій у клітині за низьких температур, невисокого тиску і дуже малих концентрацій |
Будівна (структурна) | Основний будівний матеріал клітини (мембран, органоїдів) |
Захисна | Білки-антитіла здатні “розрізнювати” і знищувати хвороботворні мікроорганізми. Білки ядра гістони захищають молекули ДНК від ушкоджень. Білкові фактори згортання крові захищають організм від крововтрат |
Регуляторна (гуморальна, гормональна) | Поряд із нервовою системою гормони білкової природи керують роботою різних органів і всього організму через систему хімічних реакцій |
Сигнальна | Окремі білки клітинних мембран здійснюють прийом сигналів і передачу їх всередину клітини |
Скорочувальна (рухова) | Усі види рухів виробляються особливими видами скорочувальних білків |
Транспортна | Транспортні білки крові переносять кисень та органічні речовини |
Енергетична | При окисненні 1 г білка вивільняється 17,2 кДж енергії |
Схема ферментативної реакції
Нуклеїнові кислоти
У 1868 р. швейцарський лікар І. Ф. Мішер виявив у ядрах лейкоцитів, що входять до складу гною, речовини кислотної природи, які він назвав нуклеїновими кислотами (від латин, nucleus – ядро). Згодом нуклеїнові кислоти були виявлені у всіх рослинних і тваринних клітинах, вірусах, бактеріях і грибах.
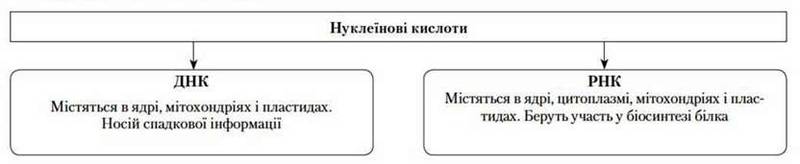
Нуклеїнові кислоти – складні високомолекулярні біополімери, мономерами яких є нуклеотиди. У клітинах присутні дизоксирибонуклеїнові (ДНК) та рибонуклеїнові (РНК) кислоти.
Будова нуклеотиду

Будова молекули нуклеїнової кислоти
Окремі нуклеотиди сполучаються між собою у ланцюг за допомогою особливих чмістків, які виникають між залишками пентоз двох сусідніх нуклеотидів за участю залишків фосфорної кислоти.
Нуклеїновим кислотам притаманна первинна структура – певна послідовність розташування нуклеотидів, а також складніша просторова будова, яка формується за рахунок водневих зв’язків.
Види нуклеїнових кислот
Рибонуклеїнова кислота

Дезоксирибонуклеїнова кислота
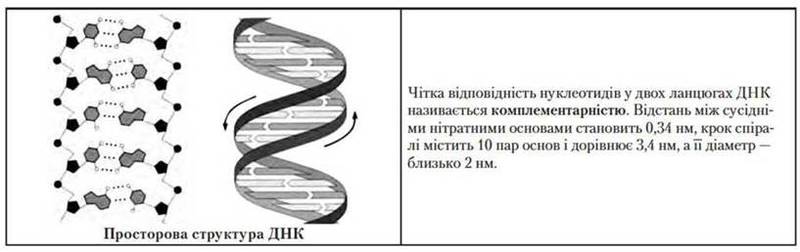
У1953 р. англійські вчені Дж. Уотсон і Ф. Крик запропонували модель просторової структури ДНК. Вони показали, що ДНК складається з двох полінуклеотидних ланцюгів, спірально закручених один навколо одного. Подвійна спіраль стабілізована водневими зв’язками між нітратними основами різних ланцюгів так, що проти аденіну одного ланцюга завжди стоїть тимін іншого, а проти гуаніну – цитозин. Багаторазове повторення цих зв’язків надає великої стійкості подвійній спіралі ДНК. За певних умов (дія кислот, лугів, нагрівання тощо) відбувається денатурація ДНК – розрив водневих зв’язків між комплементарними нітратними основами. Денатурована ДНК може відновити двоспіральну будову завдяки встановленню водневих зв’язків між комплементарними нуклеотидами – цей процес називається ренатурацією.

Джеймс Уотсон (нар. 1928)

Френсіс Крик (нар. 1916)
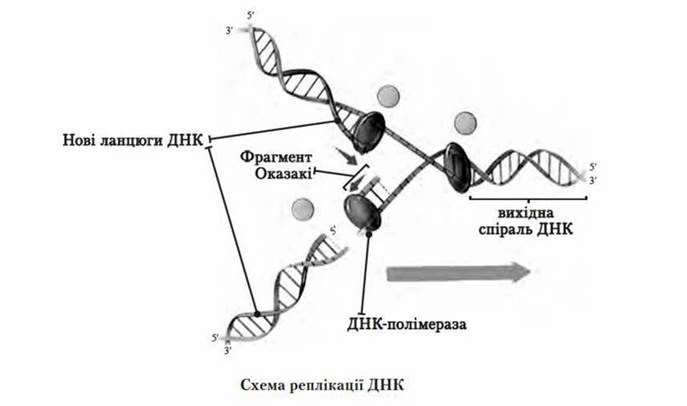
Реплікація ДНК
Принцип комплементарності лежить в основі здатності молекули ДНК до реплікації – самоподвоєння.
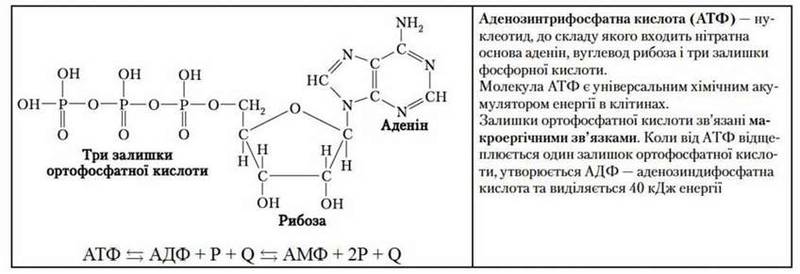
Аденозинтрифосфатна кислота
Т.
Амінокислоти – структурні мономери білків

Амінокислоти сполучаються між собою ковалентним зв’язком між карбоксильною групою однієї амінокислоти та аміногрупою іншої. Такий зв’язок називається пептидним. Амінокислоти об’єднуються за допомогою пептид – них зв’язків у пептиди.

Схема утворення пептидного зв’язку
Види білків (за складом)

Просторова структура білків

Порушення природної структури білків
Під впливом різних фізико-хімічних чинників (дія концентрованих кислот і лугів, важких металів, високої температури тощо) структура та властивості білків можуть змінюватися.
Процес порушення природної структури білка або розгортання поліпептидного ланцюга без руйнування пептидних зв’язків називається денатурацією.
Денатурація має необоротний характер. Однак на перших стадіях, за умов припинення дії негативних чинників, білок може відновлювати свій нормальний стан (ренатурація).
Процес руйнування первинної структури білків завжди необоротний, він називається деструкцією.
Функції білків
Функція | Характеристика |
Ферментативна (біокаталіз) | Ферменти забезпечують перебіг хімічних реакцій у клітині за низьких температур, невисокого тиску і дуже малих концентрацій |
Будівна (структурна) | Основний будівний матеріал клітини (мембран, органоїдів) |
Захисна | Білки-антитіла здатні “розрізнювати” і знищувати хвороботворні мікроорганізми. Білки ядра гістони захищають молекули ДНК від ушкоджень. Білкові фактори згортання крові захищають організм від крововтрат |
Регуляторна (гуморальна, гормональна) | Поряд із нервовою системою гормони білкової природи керують роботою різних органів і всього організму через систему хімічних реакцій |
Сигнальна | Окремі білки клітинних мембран здійснюють прийом сигналів і передачу їх всередину клітини |
Скорочувальна (рухова) | Усі види рухів виробляються особливими видами скорочувальних білків |
Транспортна | Транспортні білки крові переносять кисень та органічні речовини |
Енергетична | При окисненні 1 г білка вивільняється 17,2 кДж енергії |
Схема ферментативної реакції

Нуклеїнові кислоти
У 1868 р. швейцарський лікар І. Ф. Мішер виявив у ядрах лейкоцитів, що входять до складу гною, речовини кислотної природи, які він назвав нуклеїновими кислотами (від латин, nucleus – ядро). Згодом нуклеїнові кислоти були виявлені у всіх рослинних і тваринних клітинах, вірусах, бактеріях і грибах.
Нуклеїнові кислоти – складні високомолекулярні біополімери, мономерами яких є нуклеотиди. У клітинах присутні дизоксирибонуклеїнові (ДНК) та рибонуклеїнові (РНК) кислоти.
Будова нуклеотиду

Будова молекули нуклеїнової кислоти
Окремі нуклеотиди сполучаються між собою у ланцюг за допомогою особливих чмістків, які виникають між залишками пентоз двох сусідніх нуклеотидів за участю залишків фосфорної кислоти.
Нуклеїновим кислотам притаманна первинна структура – певна послідовність розташування нуклеотидів, а також складніша просторова будова, яка формується за рахунок водневих зв’язків.
Види нуклеїнових кислот

Рибонуклеїнова кислота

Дезоксирибонуклеїнова кислота
У1953 р. англійські вчені Дж. Уотсон і Ф. Крик запропонували модель просторової структури ДНК. Вони показали, що ДНК складається з двох полінуклеотидних ланцюгів, спірально закручених один навколо одного. Подвійна спіраль стабілізована водневими зв’язками між нітратними основами різних ланцюгів так, що проти аденіну одного ланцюга завжди стоїть тимін іншого, а проти гуаніну – цитозин. Багаторазове повторення цих зв’язків надає великої стійкості подвійній спіралі ДНК. За певних умов (дія кислот, лугів, нагрівання тощо) відбувається денатурація ДНК – розрив водневих зв’язків між комплементарними нітратними основами. Денатурована ДНК може відновити двоспіральну будову завдяки встановленню водневих зв’язків між комплементарними нуклеотидами – цей процес називається ренатурацією.

Джеймс Уотсон (нар. 1928)

Френсіс Крик (нар. 1916)

Реплікація ДНК
Принцип комплементарності лежить в основі здатності молекули ДНК до реплікації – самоподвоєння.

Аденозинтрифосфатна кислота
