Білки як високомолекулярні сполуки. Головні амінокислоти, що беруть участь в утворенні білків. Рівні структурної організації білків. Властивості білків: гідроліз, денатурація, кольорові реакції
II Семестр
Тема 5. НІТРОГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ
Урок 54
Тема уроку. Білки як високомолекулярні сполуки. Головні амінокислоти, що беруть участь в утворенні білків.
Рівні структурної організації білків. Властивості білків: гідроліз, денатурація, кольорові реакції
Цілі уроку: формувати в учнів поняття про білки як природні високомолекулярні сполуки, первинну, вторинну, третинну й четвертинну структури білкових молекул; ознайомити з фізичними й хімічними властивостями білків на прикладі гідролізу та денатурації; продемонструвати
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: евристична бесіда, навчальна лекція, демонстраційний експеримент.
Демонстрація 4. Розчинення й денатурація білків.
Обладнання: мультимедійна схема структури білкової молекули.
ХІД УРОКУ
I. Організація класу
II. Актуалізація
Мотивація навчальної діяльності
Фронтальна робота
1) Які функціональні групи входять до складу амінокислот?
2) Складіть схему утворення дипептиду з аланіну й цистеїну. Який зв’язок називається пептидним?
3) Скільки трипептидів можна одержати шляхом з’єднання трьох різних амінокислотних залишків?
4) Самостійно виберіть із таблиці три амінокислоти та складіть формули утворених ними трипептидів.
III. Вивчення нового матеріалу
БІЛКИ – ПРИРОДНІ ПОЛІМЕРИ
1. Будова білкової макромолекули
Бесіда
Згадайте з біології, що таке білки?
Білки (поліпептиди) – це природні високомолекулярні нітрогеновмісні органічні сполуки (біополімери), побудовані із залишків а-амінокислот, з’єднаних пептидними (амідними) зв’язками.
У живих організмах амінокислотний склад білків визначається генетичним кодом, у синтезі в більшості випадків використовуються двадцять стандартних амінокислот. Безліч їхніх комбінацій дають велику розмаїтість властивостей молекул білків. Крім того, амінокислоти в складі білка часто зазнають посттрансляційних модифікацій, що можуть виникати й до того, як білок починає виконувати свою функцію, і під час його “роботи” у клітині. часто в живих організмах кілька молекул білків утворюють складні комплекси, наприклад фотосинтетичний комплекс.
Функції білків у клітинах живих організмів більш різноманітні, ніж функції інших біополімерів – полісахаридів і ДНК. Так, білки-ферменти каталізують перебіг біохімічних реакцій і відіграють важливу роль в обміні речовин. Деякі білки виконують структурну або механічну функцію, утворюючи цитоскелет, що підтримує форму клітин. Крім цього, білки відіграють важливу роль у сигнальних системах клітин, під час імунної відповіді та в клітинному циклі.
Білки – важлива частина харчування тварин і людини, оскільки в їхньому організмі не можуть синтезуватися всі необхідні амінокислоти й частина з них надходить з білковою їжею. У процесі травлення ферменти руйнують спожиті білки до амінокислот, що використовують у біосинтезі білків організму, або піддаються подальшому розпаду для одержання енергії.
Визначення амінокислотної послідовності першого білка – інсуліну – принесло Фредеріку Сенгеру Нобелівську премію з хімії в 1958 р. Перші тривимірні структури білків гемоглобіну й міоглобіну одержали, відповідно, Макс Перуц і Джон Кендрю в 1958 р., за що в 1962 р. вони отримали Нобелівську премію з хімії.
2. Фізичні властивості білків
Білки відрізняються за ступенем розчинності у воді, але більшість із них у ній розчиняються. До нерозчинних належать, наприклад, кератин (білок, з якого складаються волосся, шерсть ссавців, пір’я птахів та ін.) і фіброїн, який входить до складу шовку й павутиння. Білки також поділяються на гідрофільні й гідрофобні. До гідрофільних належить більшість білків цитоплазми, ядра й міжклітинної речовини, у тому числі нерозчинні кератин і фіброїн; до гідрофобних – більшість білків, що входять до складу біологічних мембран.
Розмір білка може вимірюватися числом амінокислот або в дальтонах (молекулярна маса), частіше, через відносно велику величину молекули в похідних одиницях, – у кілодальтонах (кДа). Білки дріжджів у середньому складаються з 466 амінокислот і мають молекулярну масу 53 кДа. Найбільший з відомих наразі білків – тітин – є компонентом саркомерів м’язів; молекулярна маса його різних ізоформ варіює в інтервалі від 3000 до 3700 кДа; він складається з 38 138 амінокислот (у людському м’язі solius).
3. Синтез білків
¦ Як називається реакція утворення білкових полімерів?
Формальне утворення білкової макромолекули можна представити як реакцію поліконденсації?-амінокислот:
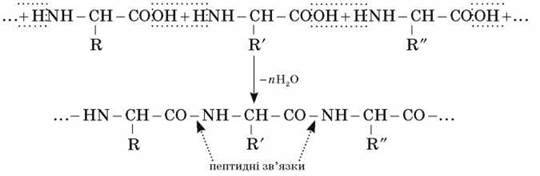
Під час взаємодії двох молекул а-амінокислот відбувається реакція між аміногрупою однієї молекули й карбоксильною групою – іншої. Це приводить до утворення дипептиду, наприклад:
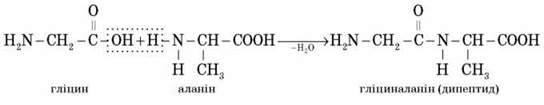
Слід відзначити, що в штучних умовах (поза організмом) дві різні амінокислоти можуть утворити чотири ізомерні дипептиди (у цьому випадку – гліцилаланін, аланілгліцин, аланілаланін і гліцилгліцин).
З трьох молекул а-амінокислот (гліцин + аланін + гліцин) можна одержати трипептид:
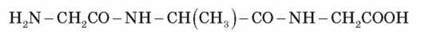
Гліцилаланілгліцин
Аналогічно відбувається утворення тетра-, пента – й поліпептидів.
Молекулярні маси різних білків (поліпептидів) становлять від 10 тисяч до кількох мільйонів. Макромолекули білків мають стереорегулярну будову, винятково важливу для прояву ними певних біологічних властивостей. Незважаючи на численність білків, до їхнього складу входять залишки лише двадцяти?-амінокислот.
4. Структурні форми білкових молекул
Різноманітні функції білків визначаються а-амінокислотним складом і будовою їхніх високоорганізованих макромолекул.
Виділяють чотири рівні структурної організації білків.
(Учитель і учні коментують схему будови білкових молекул.)
¦ Які структури організації білкових молекул ви вивчали на уроках хімії та біології?
¦ Яку функцію виконує первинна структура білка?
¦ Якими зв’язками утворюється вторинна структура білка?
¦ Які функціональні групи в білкових молекулах беруть участь в утворенні третинної структури білка?
Первинна структура – певна послідовність а-амінокислотних залишків у поліпептидному ланцюзі
Вторинна структура (?-спіраль)
Вторинна структура – це конформація поліпептидного ланцюга, закріплена численними водневими зв’язками між групами N – H і C = O.
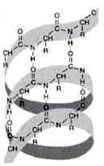
Одна з моделей вторинної структури – ?-спіраль

Друга модель – ?-форма (“складчастий лист”), у якій переважають міжланцюгові (міжмолекулярні) водневі зв’язки
Третинна структура
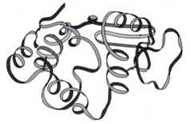
Третинна структура – форма закрученої спіралі в просторі, утвореної, в основному, за рахунок дисульфідних містків – S-S-, водневих зв’язків, гідрофобних та іонних взаємодій
Четвертинна структура

Четвертинна структура – агрегати кількох білкових макромолекул (білкові комплекси), утворені за рахунок взаємодії різних поліпептидних ланцюгів
– За якими ознаками білки поділяються на прості та складні?
До складу багатьох білків, крім пептидних ланцюгів, входять і неамінокислотні фрагменти. За цим критерієм білки поділяють на дві великі групи – прості та складні білки (протеїди). Прості білки містять лише амінокислотні ланцюги, складні білки – ще й неамінокислотні фрагменти. Ці фрагменти небілкової природи в складі складних білків називаються “простетичними групами”. Залежно від хімічної природи простетичних груп з-поміж складних білків виокремлюють такі класи:
– глікопротеїди, що як простетичну групу містять ковалентно зв’язані вуглеводневі залишки та їхній підклас – протеоглікани, з мукополісахаридними простетичними групами. В утворенні зв’язку з вуглеводними залишками зазвичай беруть участь гідроксильні групи серіну або треоніну. Переважна частина позаклітинних білків, зокрема імуноглобуліни, – глікопротеїди. У протеогліканах вуглеводна частина становить близько 95 %, вони є головним компонентом міжклітинного матрикса;
– ліпопротеїди, що як простетичну частину містять нековалентно зв’язані ліпіди. Ліпопротеїди утворені білками-аполіпопротеїнами та ліпідами, що зв’язуються з ними, і виконують функцію транспортування ліпідів;
– металопротеїди, що містять негемові координаційно зв’язані йони металів. Серед металопротеїдів існують білки, що виконують функції депонування і транспортування (наприклад, ферумовмісні ферітин і трансферін), і ферменти (наприклад, цинковмісна карбоангідраза й різні супероксиддисмутази, що як активні центри містять іони Купруму, мангану, Феруму та інших металів);
– нуклеопротеїди, що містять нековалентно зв’язані ДНК або РНК, зокрема хроматин, з якого складаються хромосоми, є нуклеопротеїдом;
– фосфопротеїди, що як простетичну групу містять ковалентно зв’язані залишки фосфатної кислоти. В утворенні естерового зв’язку з фосфатом беруть участь гідроксильні групи серіну або треоніну; фосфопротеїном є, зокрема, казеїн молока;
– хромопротеїди – збірна назва складних білків із забарвленими простетичними групами різної хімічної природи. До них належить безліч білків з металовмісною порфіриновою простетичною групою, які виконують різноманітні функції: гемопротеїни (білки, що як простетичну групу містять гем, – гемоглобін, цитохроми та ін.), хлопрофіли; флавопротеїди із флавіновою групою та ін.
5. Хімічні властивості білків
1) Гідроліз білків
Він є гідролізом поліпептидного ланцюга з утворенням набору амінокислот, що утворили цей поліпептидний ланцюг.
2) Демонстрація 4. Розчинення й денатурація білків Денатурація – руйнування третинної та вторинної структур білкової молекули під дією нагрівання, сильних кислот, лугів, солей важких металів, спиртів, радіації.
На прикладі яєчного білка демонструємо денатурацію внаслідок нагрівання, під дією сульфатної кислоти, натрій гідроксиду, спирту.
Зазвичай білки зберігають структуру, а отже, фізико-хімічні властивості, наприклад розчинність, у таких умовах, як температура і рН, до яких пристосований певний організм. різка зміна цих умов, наприклад, нагрівання або обробка білка кислотою чи лугом, призводить до втрати четвертинної, третинної та вторинної структур білка, що називається денатурацією. Найвідоміший випадок денатурації білка в побуті – приготування курячого яйця, коли під впливом високої температури розчинний у воді прозорий білок овальбумін стає щільним, нерозчинним і непрозорим. Денатурація в деяких випадках оборотна, як у разі осадження (преципітації) водорозчинних білків з допомогою солей амонію, і використовується як спосіб їх очищення.
III. Первинне застосування одержаних знань
Керована практика
Демонстрація 4. Розчинення й осадження білків
1) Яєчний білок поміщаємо в хімічну склянку, додаємо води (1:1), розмішуємо. Що спостерігаємо? Зробіть висновок про розчинність білка.
2) Наливаємо 1-2 мл одержаного розчину в пробірку. Дотримуючись правил техніки безпеки, нагріваємо до згортання білка.
3) Наливаємо 1-2 мл розчину білка в пробірку, доливаємо 1-2 мл спирту (98 %). Що спостерігаємо?
Зробіть висновок про умови денатурації білка.
V. Підбиття підсумків уроку
Повідомлення учнів про біологічну роль білків
Функції білків у природі є універсальними:
– каталітичні (ферменти);
– регуляторні (гормони);
– структурні (кератин шерсті, фіброїн шовку, колаген);
– рухові (актин, міозин);
– транспортні (гемоглобін);
– запасні (казеїн, яєчний альбумін);
– захисні (імуноглобуліни) тощо.
Підбиваємо підсумки уроку, оцінюємо роботу учнів на уроці.
VІ. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання: підготувати повідомлення про біологічну роль білків. Чому білкову їжу не можна на тривалий час замінити їжею, що містить лише жири й вуглеводи?