Добування кисню
Розділ 2 Кисень
20 Добування кисню
Матеріал параграфа допоможе вам:
> порівняти методи добування кисню у промисловості i лабораторії;
> з’ясувати, що таке реакція розкладу;
> розуміти особливості способів збирання кисню, добутого під час досліду.
Відкриття к исто. Кисень був відкритий у другій половині XVTII ст. кількома вченими різних країн. Першим цей газ добув шведський хімік К.-В. Шеєле в 1772 p., а через два роки, не знаючи про досліди попередника, – англійський хімік Дж. Прістлі. У 1775 р. французький учений А.-Л. Лавуазье
Кисень можна виявити за допомогою жевріючої скіпки. Вміщена в посудину із цим газом, вона яскраво спалахує (мал. 53).

Мал. 53. Виявлення кисню:
А – жевріюча скіпка на повітрі; б – спалахування скіпки в кисні
Добування кисню в промисловості. Невичерпним джерелом кисню є повітря. Щоб добути з нього кисень, треба відокремити цей газ від азоту та інших газів. На такій ідеї грунтується промисловий метод добування кисню. Його реалізують, використовуючи спеціальну, досить громіздку апаратуру. Спочатку повітря сильно охолоджують до перетворення
Рідкий кисень транспортують у спеціальних сталевих резервуарах, що мають подвійні стінки, між якими створено вакуум (для ефективної теплоізоляції). Газуватим киснем наповнюють під високим тиском балони; їх фарбують у блакитний колір (мал. 54).
Добування кисню в лабораторії. Кисень добувають у лабораторії, здійснюючи певні хімічні реакції.

Мал. 54. Балон із киснем
Дж. Прістлі добув кисень зі сполуки, назва якої – меркурій(П) оксид. Учений нагрівав сполуку за допомогою скляної лінзи, яка фокусувала сонячне світло на речовині.
У сучасному виконанні цей дослід зображено на малюнку 55. Жовтий порошок меркурій(ІІ) оксиду1 під час нагрівання перетворюється на ртуть і кисень. Ртуть виділяється в газоподібному стані й конденсується на стінках пробірки у вигляді сріблястих крапель. Кисень накопичується в другій пробірці (її попередньо заповнюють водою).
Хімічне рівняння цієї реакції:
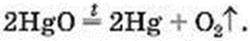
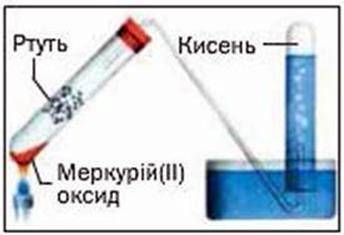
Мал. 55. Добування кисню нагріванням меркурій(ІІ) оксиду
Нині метод Прістлі не використовують через токсичність парів ртуті. Кисень добувають за допомогою інших реакцій, подібних до щойно розглянутої. Вони, як правило, відбуваються при нагріванні.
1 У багатьох хімічних назвах, які складаються із двох слів, відмінюється лише друге слово.
Реакції, під час яких із однієї речовини утворюється кілька інших, називають реакціями розкладу.
Для добування кисню в лабораторії найчастіше використовують такі оксигеновмісні сполуки:
– калій перманганат КМnO4 (побутова назва – марганцівка; водний розчин речовини є дезінфікуючим засобом)
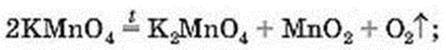
– калій хлорат КСlO3 (інша назва – бертолетова сіль, на честь французького хіміка кінця XVIII – початку XIX ст. К. Л. Бертолле)
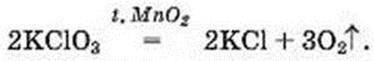
Щоб розклад калій хлорату відбувався з виділенням кисню, до сполуки додають невелику кількість манган(ІV) оксиду МnO2 (цю хімічну формулу записано над знаком рівності в хімічному рівнянні)1.
Речовину, яка спричиняє перебіг реакції або прискорює її, залишаючись після реакції незмінною, називають каталізатором2.
Manran(IV) оксид у ролі каталізатора використовують також при добуванні кисню із водного розчину гідроген пероксиду Н2О2 (інша назва – перекис водню). Якщо у цей розчин додати невелику кількість указаної сполуки Мангану, спостерігатимемо інтенсивне виділення кисню3. Реакція відбувається згідно з рівнянням
МnО2
2НО2 = 2Н2О + О2↑.
1 Якщо сполуку Мангану не добавляти, відбувається інша реакція.
2 Термін походить від грецького слова katalysis – руйнування.
3 Гідроген пероксид без каталізатора розкладається дуже повільно.
Кисень можна добути розкладом натрій нітрату NaNО3або калій нітрату KNО3. Ці сполуки під час нагрівання спочатку плавляться, а потім розкладаються:
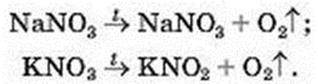
► Перетворіть схеми реакцій на хімічні рівняння.
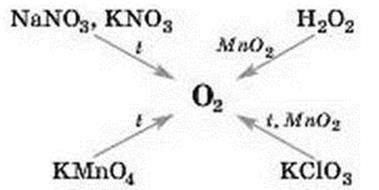
Відомості про те, як можна добути кисень у лабораторії, узагальнює схема 5.
Схема 5
Лабораторні методи добування кисню
Способи збирання кисню. На малюнках 55 і 56, а показано, як збирають кисень, витискуючи ним воду із посудини. Це вдається зробити, бо кисень розчиняється у воді дуже слабко. Зібраний таким способом газ містить домішку водяної пари.
Інший спосіб збирання кисню полягає у витисненні ним повітря із посудини. Оскільки кисень трохи важчий за повітря, пробірку або колбу розміщують донизу дном і накривають скляною пластинкою або шматком картону чи пластику (мал. 56, б).

Мал. 56. Збирання кисню:
А – витисненням води; б – витисненням повітря
Кисень було відкрито наприкінці XVIII ст. кількома вченими.
Кисень добувають у промисловості з повітря, а в лабораторії – за допомогою реакцій розкладу деяких оксигеновмісних сполук.
Реакції, під час яких з однієї речовини утворюється щонайменше дві, називають реакціями розкладу.
У лабораторії кисень збирають витисненням із посудини води або повітря.
?
146. Як добувають кисень у промисловості? Чому, на вашу думку, для цього не використовують калій перманганат, гідроген пероксид?
147. Які реакції називають реакціями розкладу?
148. Перетворіть на хімічні рівняння схеми реакцій, під час яких утворюється кисень:
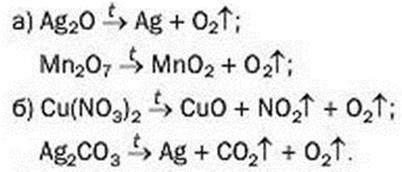
149. Що таке каталізатор?
150. Якими способами можна збирати кисень під час його добування в лабораторії? На яких фізичних властивостях кисню грунтується кожний спосіб? В якому разі візуально не можна встановити момент, коли посудина повністю заповнена киснем?
151. На малюнку 57 зафіксовано момент розкладу білої твердої речовини – кадмій нітрату Cd(NО3)2. Уважно розгляньте малюнок і опишіть, що відбувається під час реакції. Чому спалахує жевріюча скіпка? Складіть відповідне хімічне рівняння.

Мал. 57. Розкладання речовини під час нагрівання
152. Масова частка Оксигену в залишку після нагрівання калій нітрату KNО3 становила 40 %. Чи повністю розклалася ця сполука?
153. Підготуйте за матеріалами з інтернету короткі повідомлення про наукові здобутки хіміків К.-В. Шеєле, Дж. Прістлі та К. Л. Бертолле.
ПРАКТИЧНА РОБОТА №4
Добування кисню, збирання і доведення його наявності
Перед виконанням роботи уважно прочитайте правила роботи і безпеки в хімічному кабінеті (с. 17, 28).
Будьте обережними з вогнем.
Складання приладу. Прилад для добування газу складається із пробірки та гумової пробки з отвором, у який вставлена трубка (її називають газовідвідною). Зберіть його (мал. 58). Для цього щільно закрийте пробірку пробкою з газовідвідною трубкою, ніби вкручуючи пробку. Не докладайте надмірних зусиль, щоб не тріснуло скло.

Мал. 58. Прилад для добування газу

Мал. 59. Перевірка приладу на герметичність

Мал. 60. Добування кисню
Перевірка приладу на герметичність. У невелику склянку налийте води до половини її об’єму. Кінець газовідвідної трубки занурте у воду і зігрійте пробірку рукою (мал. 59). Якщо з’єднання пробірки, пробки і трубки герметичні, то за кілька секунд із трубки виходитимуть бульбашки повітря. (Об’єм будь-якого газу при підвищенні температури зростає.) Якщо повітря з трубки не виділяється, роз’єднайте частини приладу, а потім знову з’єднайте їх. Можна замінити пробірку або пробку з газовідвідною трубкою на інші – більшого чи меншого розміру.
Добування і збирання кисню. Розберіть прилад. Налийте у пробірку (до 1/4-1/3 її об’єму) розчин гідроген пероксиду і додайте до нього трохи порошку манган(ІV) оксиду. Що спостерігаєте? Одразу закрийте пробірку пробкою з газовідвідною трубкою, поставте у штатив для пробірок1, а кінець трубки опустіть до дна іншої пробірки (мал. 60).
Виявлення кисню. Запаліть спиртівку чи сухе пальне, підпаліть від полум’я довгу дерев’яну скіпку і пригасіть її (як це ви робите із сірником), щоб вона ледве жевріла. За допомогою скіпки доведіть, що зібраний газ – кисень.
1 Або закріпіть пробірку вертикально в лабораторному штативі за допомогою ланки.
По завершенні експерименту погасіть скіпку, розберіть прилад, вилийте вміст пробірки в спеціальну посудину і вимийте пробірку.
Назви етапів роботи, спостереження, висновки, а також рівняння реакції розкладу гідроген пероксиду запишіть у таблицю:
Назва етапу роботи | Спостереження | Висновки |
… | … | … |
Рівняння реакції: |
?
154. Що відбуватиметься із жевріючою скіпкою, якщо пробірка буде заповнена киснем частково?
155. Як можна видалити зібраний кисень із пробірки?
ДОМАШНІЙ ЕКСПЕРИМЕНТ
Каталітична дія речовин, які містяться в овочах і м’ясі, на розклад гідроген пероксиду
Виконавши практичну роботу № 4. ви пересвідчились у тому, що манган(№) оксид є каталізатором розкладу гідроген пероксиду. Пропонуємо вам перевірити, чи містяться в овочах і м’ясі речовини, які також каталізують цю реакцію.
Підготуйте невеликі шматочки свіжих овочів (картоплі, моркви, буряка, чорної редьки, кореня селери тощо), а також м’яса. Нанесіть на кожний шматочок по 2-3 краплі розчину гідроген пероксиду (цей розчин можна придбати в аптеці). Що спостерігаєте? На якому зразку (зразках) кисень виділяється найбільш інтенсивно?
Проведіть такий самий експеримент із відвареними шматочками овочів і м’яса. Чи спостерігаєте виділення газу? Якщо ні, то чому, на вашу думку, отримано інший результат?