ДОБУВАННЯ ТА ЗБИРАННЯ КИСНЮ. ПОНЯТТЯ ПРО КАТАЛІЗАТОРИ. РЕАКЦІЯ РОЗКЛАДУ
Тема 2 КИСЕНЬ
& 25. ДОБУВАННЯ ТА ЗБИРАННЯ КИСНЮ. ПОНЯТТЯ ПРО КАТАЛІЗАТОРИ. РЕАКЦІЯ РОЗКЛАДУ
Вивчення параграфа допоможе вам:
· складати рівняння реакції добування кисню з гідроген пероксиду;
· зрозуміти роль каталізаторів;
· наводити приклади і пояснювати суть реакцій розкладу;
· дізнатись про способи збирання газів
Щоб проводити у хімічній лабораторії досліди з киснем, його добувають із деяких оксигеновмісних речовин. Як саме це роблять, ви дізнаєтесь з параграфа.
ПОНЯТТЯ ПРО КАТАЛІЗАТОР. У шкільній
Каталізаторами називають речовини, які прискорюють хімічні реакції інших речовин, але при цьому самі не витрачаються і не входять
Каталізатори використовують не лише у лабораторіях, а й на хімічних заводах для виробництва різних речовин. Багато каталізаторів міститься в організмі людини. Вони мають загальну назву ферменти. За участю ферментів відбуваються тисячі хімічних реакцій, що забезпечують перетворення речовин та енергії, тобто життєдіяльність організмів.
Існують також речовини, які, навпаки, не прискорюють, а сповільнюють реакції інших речовин і теж при цьому не витрачаються. Їх називають інгібітори. Каталізатори та інгібітори – речовини багаторазової дії.
СПОСОБИ ЗБИРАННЯ КИСНЮ ТА ІНШИХ ГАЗІВ. Існує два способи збирання газоподібних речовин: витісненням води (мал. 84а) та витісненням повітря (мал. 84б, в). Важливо завчасно продумувати, яким з них доцільно скористатися у конкретному випадку.
Витісненням води збирають лише ті гази, які в ній погано розчиняються. Якщо газоподібна речовина добре розчиняється у воді, то не витісняє її з посудини
Ви вже знаєте, що кисень погано розчинний у воді. Тому для його збирання можна скористатися цим способом.
Другим способом збирання газів – витісненням повітря – можна збирати всі газоподібні речовини. Слід лише визначитись з тим, як розташовувати посудину-приймач – донизу (мал. 84б) чи догори (мал. 84в) дном.
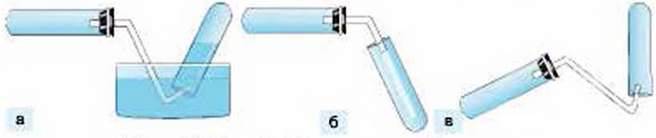
Мал. 84. Способи збирання газоподібних речовин
Немає сумніву, що заповнюючи пробірку водою, ви її триматимете дном донизу, а не навпаки. Тепер уявіть собі, що ви надумали заповнити пробірку водою, тримаючи її догори дном. Що з цього вийде? Щось подібне спостерігатиметься, якщо ви будете наповнювати пробірку важчим за повітря газом, що розташована догори дном. Він “виливатиметься”, а точніше буде опускатися вниз, а не підніматиметься вгору. Зібрати такті газ у розташовану догори дном пробірку вам не вдасться.
Зовсім по-іншому поводить себе газ, легший за повітря. Виділившись через газовідвідну трубку, він піднімається вгору. Там йому на перепоні стає дно пробірки-приймача, розташованої догори дном, і газ залишається в ній. Якщо ж такий газ збирати в пробірку, розташовану донизу дном, то він не опускатиметься на дно пробірки, а підніматиметься вгору й полишить пробірку.
Легші за повітря гази збирають способом витіснення повітря, тримаючи посудину-приймач догори дном. Для збирання важчого за повітря газу пробірку тримають донизу дном.
Оскільки кисень трохи важчий за повітря, його збирають, тримаючи пробірку донизу дном.
Слід пам’ятати про те, що при добуванні кисню та інших газів пробка з газовідвідною трубкою повинна щільно (герметично) закривати отвір пробірки. Якщо цього не буде, то кисень виділятиметься не лише через газовідвідну трубку, а й через нещільно вставлену пробку. Тому перед проведенням досліду з добування газу пробірку й газовідвідну трубку з пробкою перевіряють на герметичність так, як це показано на малюнку 85. Якщо прилад зібрано герметично, досить швидко у воді з’являться бульбашки газу. Це повітря, яке від нагрівання теплом долоні розширилося і надійшло у воду через газовідвідну трубку.
ДОБУВАННЯ КИСНЮ З ГІДРОГЕН ПЕРОКСИДУ. Для добування кисню з гідроген пероксиду змонтуємо прилад, як показано на малюнку 86а і приготуємо все необхідне для його збирання витісненням повітря (мал. 86б) та витісненням води (мал. 86в).
Наллємо у круглодонну колбу з бічним відгалуженням, на якому закріплена газовідвідна трубка, невелику кількість розчину гідроген пероксиду. Додамо на кінчику шпателя каталізатора манган(ІV) оксиду МnO2 та відразу закриємо колбу пробкою, у яку вмонтовано крапельну лійку. Без будь-якого нагрівання відразу ж розпочинається реакція, про що свідчить “закипання” гідроген пероксиду. Піднесена до отвору газовідвідної трубки тліюча скіпка яскраво спалахує. Це доводить, що виділяється кисень.
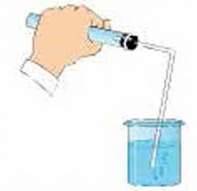
Мал. 85. Перевірка на герметичність приладу для добування газів
Наявність кисню можна довести за допомогою тліючої скіпки. За наявності кисню вона яскраво спалахує.
Послідовно заповнимо киснем, що виділяється, колбу – способом витіснення повітря (мал. 86, б) та пробірку – витісненням води (мал. 86, в). Зберемо спершу кисень шляхом витіснення повітря у конічну колбу, тримаючи її донизу дном (мал. 86, б). Цей спосіб простий, проте неточний, оскільки кисень теж безбарвний і ступінь наповнення колби газом потребує контролю. Тому наповнення посудини киснем час від часу перевірятимемо піднесенням тліючої скіпки до отвору колби.

Мал. 86. Добування кисню з гідроген пероксиду та збирання його
Зберемо кисень у пробірку, але вже способом витіснення води. Добре видно, як бульбашки кисню витісняють воду з пробірки. Як тільки воду повністю буде витіснено, закриємо пробірку під водою пластинкою чи пробкою, дістанемо її звідти та поставимо у штатив для пробірок. Тліючою скіпкою переконаймося, що пробірка наповнена киснем.
Увага! Після завершення збирання кисню кінець газовідвідної трубки не залишають у посудині з водою. Тому що після закінчення реакції через газовідвідну трубку в колбу з гідроген пероксидом почне швидко надходити вода із посудини.
РЕАКЦІЇ РОЗКЛАДУ. Утворення у проведеному досліді нової речовини – кисню – свідчить про перебіг хімічного явища, або хімічної реакції. Напишемо її рівняння:
2Н2О2 = 2Н2О + О2↑ (1)
У рівняннях хімічних реакцій після формул газоподібних речовин досить часто ставлять стрілку ↑.
З рівняння бачимо, що до реакції існувала одна складна речовина, а після реакції утворилися дві нові. Це – складна речовина – вода й проста речовина – кисень.
Реакції, внаслідок яких з однієї складної речовини утворюється дві чи більше нових речовин, називають реакціями розкладу.
Один із відкривачів кисню Джозеф Прістлі добув його реакцією розкладу меркурій(ІІ) оксиду:
2НgО = 2Нg + О2↑. (2)
Хімічну реакцію добування кальцій оксиду (негашеного вапна) СаО у промисловості відображає рівняння
СаСО3 = СаО + СО2↑. (3)
Проаналізуйте кількість речовин а обох рівняннях до і після реакції та їх склад. Чи належить вона до реакцій розкладу? Прості чи складні речовини є продуктами кожної з трьох розглянутих у параграфі реакцій?
Як бачимо, продуктами реакцій розкладу є прості й складні речовини, тоді як реагентом може бути лише складна речовина.
ДОБУВАННЯ КИСНЮ В ПРОМИСЛОВОСТІ. У промисловості найбільше кисню добувають у повітророзподільних установках, де спершу в умовах низьких температур газоподібне повітря перетворюються в рідину. Після цього рідке повітря повільним нагріванням розділяють на окремі його компоненти.
До промислових способів одержання кисню належить також розклад води під дією постійного електричного струму:
2Н2О = 2Н2↑ + О2↑.
Скарбничка ерудита
Гідроген пероксид Н2О2 – нестійка речовина й при тривалому зберіганні розкладається під дією світла. Щоб запобігти розкладанню, розчин гідроген пероксиду зберігають у посуді з темного скла з додаванням інгібітора – ортофосфатної кислоти Н3РО4.
Перекис водню є в кожній аптечці першої допомоги. Ним обробляють відкриті рани, діє він як сильний і безболісний знезаражувальний засіб.
?
1. Які речовини називають каталізаторами? Наведіть приклади реакцій за участю каталізаторів.
2. Які реакції належать до реакцій розкладу? Наведіть приклади.
3. Як виявити кисень дослідним шляхом?
4. Як перевірити прилад для добування газів на герметичність?
5. Якими способами можна збирати гази та що необхідно знати про газоподібну речовину, аби правильно її зібрати?
6. Укажіть речовину, яка не підлягає реакції розкладу:
А вода
Б меркурій(ІІ) оксид
В водень
Г гідроген пероксид
7. Напишіть рівняння реакцій розкладу за наведеними схемами:
A) NH4Cl → NH3↑+ НСl↑
Б) Аg2O → Аg + O2↑
В) МgСО3 = МgО + СO2↑
За рівнянням реакції б) обчисліть, яку масу аргентум(І) оксиду слід розкласти, щоб виділився кисень масою 3,2 г, якщо відомо, що маса другого продукту реакції – срібла – дорівнює 43,2 г.
8. Випишіть з тексту параграфа наведені в ньому рівняння реакцій. Що в них спільного? Формули простих речовин підкресліть однією рискою, а складних – двома.
9. Який малюнок (а, б чи в) ілюструє правильний спосіб збирання кисню витісненням повітря?
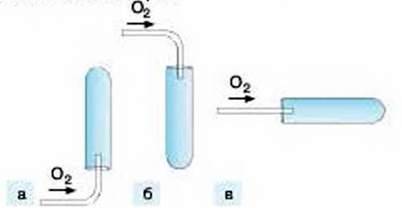
Ознайомтеся з переліком речовин, які при нагріванні легко розкладаються з виділенням кисню. Це – аргентум(І) оксид, натрієва селітра NaNO3, калієва селітра KNO3, бертолетова сіль КСlО3, калій перманганат КМnO4 та деякі інші. Пам’ятаючи, що у кожній з реакцій виділяється кисень, напишіть та перевірте у групі рівняння реакцій за схемами:
А) NaNO3 →NaNO2+?
Б) KNO3→KNO2+?
В) КСlO3 → КСl +?
Г) КМnO4 → К2МnO4 + МnO2+?