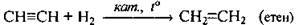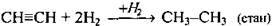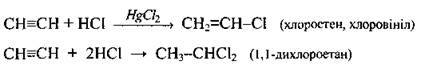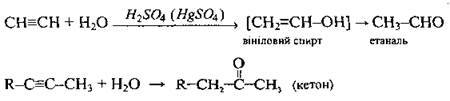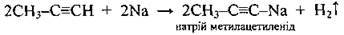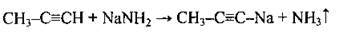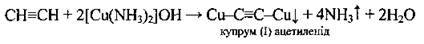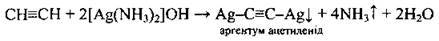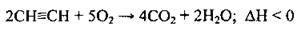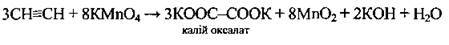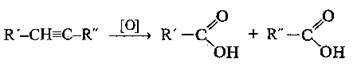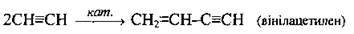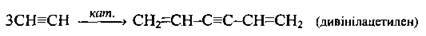Етин – Алкіни
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ III. ОРГАНІЧНА ХІМІЯ
11. Вуглеводні
11.3. Алкіни
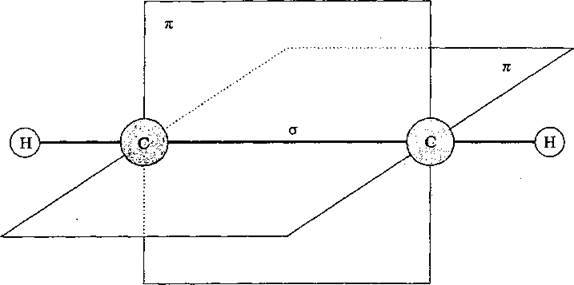
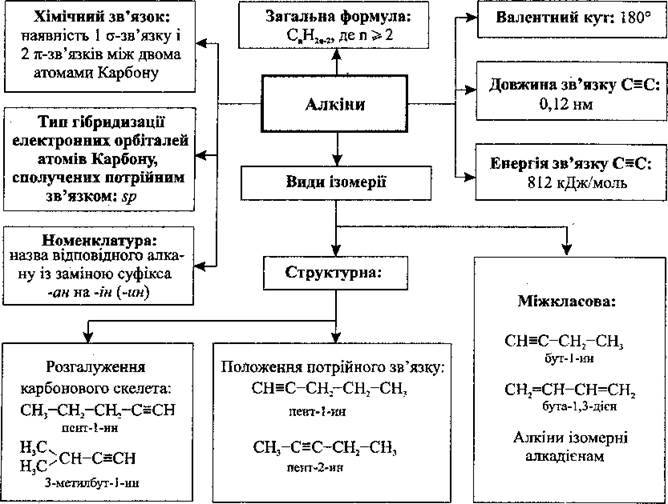
Алкіни – вуглеводні із загальною формулою СпН2n-2, у молекулах яких два атоми Карбону перебувають у стані sp-гібридизації та сполучені між собою потрійним зв’язком. Схема молекули етину:
Фізичні властивості алкінів, гомологи та ізомери
Перші алкіни С2Н2, С3Н4, С4Н6 – гази без кольору і запаху, С5Н8-С16Н30 – рідини, решта – тверді речовини.
Молекулярна формула алкіну | Структурні формули алкінів | Назва алкіну | |
Міжнародна | Тривіальна (традиційна) | ||
C2H2 | CH≡CH | Етин | Ацетилен1 |
С3H4 | СH≡С-СН3 | Пропін | Пропілен |
С4H6 | СH≡C-СН2-СН3 | Бут-1-ин | Етилацетилен |
СН3-С≡С-СН3 | Бут-2-ин | Диметилацетилен |
1 За тривіальною назвою першого члена гомологічного ряду ці вуглеводні ще називають ацетиленовими.
Номенклатура
1. Вибирають найдовший карбоновий ланцюг, який містить потрійний зв’язок:
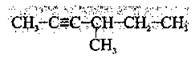
2. Нумерацію починають з того кінця, до якого найближче розташований потрійний зв’язок (згідно із принципом найменших локантів):
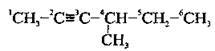
А) якщо в молекулі алкіну потрійний зв’язок рівновіддалений від обох кінців карбонового ланцюга, то нумерацію починають з того кінця, до якого ближче розташований алкільний замісник:
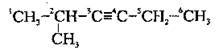
Б) якщо в молекулі алкіну подвійний зв’язок рівновіддалений від обох кінців карбонового ланцюга, то при виборі нумерації користуються алфавітним порядком (етил → метил → пропіл).
3. Назву сполуки становлять:
А) замісники, перераховані за абеткою, як і у випадку з алканами;
Б) назва алкіну, яка відповідає головному карбоновому ланцюгу (корінь), + ближчий до початку локант потрійного зв’язку + суфікс – ин (-ін), які відділяють один від одного дефісами:
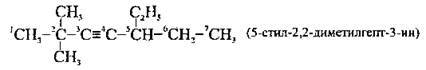
Хімічні властивості алкінів
Приєднання | ||
Гідрування (гідрогенізація) | Неповне: | Каталізатори: Pt, Ni, Pd |
Повне: | ||
Галогенування |
| |
Гідрогалогенування |
| За наявності каталізатора приєднується лише одна молекула хлороводню |
Гідратація (реакція Кучерова1) |
| Відбувається за правилом Марковникова. Вініловий спирт – речовина нестійка, ізомеризується в етаналь |
Заміщення Гідрогену біля потрійного зв’язку | ||
Активними металами |
| Утворюються ацетиленіди – солеподібні металопохідні ацетиленових вуглеводнів |
Амідами металічних елементів |
| |
Солями Купруму (І) |
| Утворюється червоно-коричневийосад |
Солями Аргентуму |
| Утворюється білий осад |
Окиснення | ||
Повне |
| Ацетилен горить, виділяючи кіптяву |
Часткове |
| Водний розчин КМnO4 повільно знебарвлюється |
Сильними окисниками |
| Окисники: К2Сr2O7 (у кислому середовищі), КМnO4, озон |
Полімеризація | ||
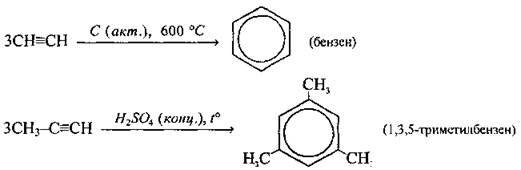
Циклоізомеризація (циклічнатримеризація) |
| |
Лінійна ди – і тримеризація |
| Каталізатори: CuCl, NH4Cl, НСl |
| ||
1 Михайло Григорович Кучеров (1850-1911) – російський хімік-органік.
Для якісного виявлення алкінів використовують реакції:
А) із бромною водою (бромна вода знебарвлюється):
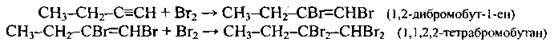
Б) окиснення алкінів водним розчином калій перманганату (розчин КМnO4 знебарвлюється):
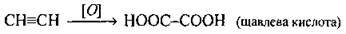
В) утворення червоно-коричневого осаду купрум (І) ацетиленіду або білого осаду аргентум ацетиленіду (якісні реакції на ацетилен).
Добування алкінів
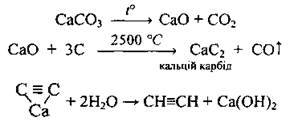
1. Карбідний метод:
2. Піроліз:
А) метану:
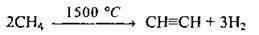
Б) етану:
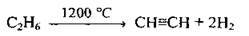
В) окислювальний піроліз метану:
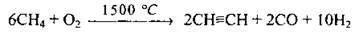
3. Із дигалогеноалканів відповідної будови:
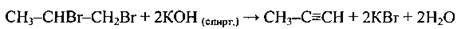
11.3.1. Етин
Найважливішою сполукою гомологічного ряду алкінів є етин (тривіальна назва – ацетилен).
За нормальних умов це безбарвний газ без запаху1, помірно розчинний у воді. За температури -80,8 °С він зріджується, а при -83,6 °С – твердне (при швидкому охолодженні твердне, минаючи рідку фазу). Вибухонебезпечний, вибухає за температури 500 °С або підвищенні тиску до 2 атм. Вибухонебезпечність зменшується при змішуванні з іншими газами (азотом, метаном чи пропаном) або при розчиненні в органічних розчинниках (за н. у. в 1 л ацетону розчиняється 25 л етину, а при 12 атм – 300 л). Зберігають і перевозять у сталевих балонах білого кольору з червоним надписом “А” (ацетилен), заповнених деревним вугіллям, у вигляді розчину в ацетоні під тиском 1,5-2,5 МПа.
Застосування етину
Його річне виробництво перевищує 5 млн. т. З них приблизно 30% використовують для автогенного зварювання і різання металів (ацетиленокисневе полум’я має температуру 3150 °С), а 70 % – у промисловому органічному синтезі:
– вибухових речовин;
– оцтової кислоти, етилового спирту, розчинників, пластмас, каучуку, аренів;
– технічного вуглецю.
______________________________________________________
1 Гострий специфічний запах з’являється в технічного етину при добуванні його з кальцій карбіду і зумовлений наявністю (дуже токсичних!) домішок – летких сполук Гідрогену: фосфіну РН3 та арсинуAsH3.