Ферум. Ферум(ІІ) і ферум(ІІІ) оксиди, відповідні їм гідроксиди, їх амфотерність. Солі Феруму. Використання найважливіших сполук Феруму
ІІ семестр
Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин)
УРОК 31
Тема уроку. Ферум. Ферум(ІІ) і ферум(ІІІ) оксиди, відповідні їм гідроксиди, їх амфотерність. Солі Феруму. Використання найважливіших сполук Феруму
Цілі уроку: поглибити й узагальнити знання учнів про метали побічних підгруп на прикладі Феруму; показати залежність будови та властивостей на прикладі сполук Феруму(ІІ) і Феруму(ІІІ); вивчити застосування заліза та сполук Феруму.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування
Форми роботи: семінар, фронтальна робота.
Обладнання: періодична таблиця хімічних елементів Д. І. Менделєєва, таблиця розчинності, схеми виробництва чавуну та сталі, колекція мінералів.
Демонстрація 5. Одержання ферум(ІІ) гідроксиду й ферум(ІІІ) гідроксиду, взаємодія їх з кислотами.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
Під час фронтальної бесіди учні записують частини схеми “Ферум. Залізо. Сполуки Феруму”.
1. Положення в періодичній системі, будова атома
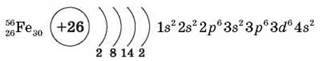
D-елемент, на зовнішньому
2. Фізичні властивості
Сріблястий, пластичний, ковкий, легко прокочується та піддається іншим видам механічної обробки.
Має здатність розчиняти в собі багато хімічних елементів (у тому числі Карбон, Силіцій). Проявляє магнітні властивості. tпл = 1 539 °С; tкип = 2 730 °С; ? = 7,87 г/см3; твердість – 35-45 н/тм2.
3. Природні сполуки Феруму
(Розглядаємо колекцію мінералів.)
4 % маси – у земній корі у складі сполук. У вільному стані трапляється в метеоритах.
Основні ферумовмісні руди:
– магнітний залізняк Fe3O4, до 72 % Fe;
– червоний залізняк, гематит Fe2O3, до 65 % Fe;
– бурий залізняк, лимоніт 2Fe2O3 – 3H2O, до 60 % Fe;
– шпатовий залізняк, сидерит FeCO3;
– пірит, залізний колчедан FeS2, до 47 % Fe;
– Fe(HCO3)2 міститься у водах мінеральних джерел.
4. Одержання
(Звертаємося до таблиць виробництва чавуну та сталі.)
1) Відновлення воднем:
Fe2O3 + 3H2 = 2Fe + 3H2O
2) Алюмінотермія:
3Fe3O4 + 8Al = 4Al2O3 + 9Fe
3) Електроліз водних розчинів.
4) Відновлення С, CO.
5. Застосування заліза
ІІІ. Вивчення нового матеріалу
Семінар за планом
1. Хімічні властивості заліза
1) У вологому повітрі швидко іржавіє, вкривається бурим нальотом гідратів Fe2O3, які внаслідок своєї рихлості не захищають залізо від подальшого окиснення.
У воді залізо інтенсивно кородує за умови достатнього доступу кисню, утворюються гідратні форми:
4Fe + 3O2 + nH2O = 2Fe2O3 – nH2O
У разі нестачі кисню утворюється змішаний оксид FeO – Fe2O3, або Fe3O4:
3Fe + 2O2 + nH2O = Fe3O4 – nH2O
Завдання 1. Допишіть рівняння реакцій:
Fe + O2 =
Fe + S =
Fe + Cl2 =
2) Взаємодія з кислотами.
У розчинах кислот:
Fe – 2e – = Fe2+
Завдання 2. Допишіть рівняння реакцій у іонно-молекулярній формі:
Fe + HCl =
Fe + H2SО4 =
У концентрованих кислотах:
Fe – 3e –  Fe3+
Fe3+
Завдання 3. Складіть ОВР, укажіть окисник, відновник:
Fe + H2SО4 
Fe + HNО3 
Залізо пасивує в 100%-й сульфатній H2SО4 і концентрованій нітратній HNО3 кислотах.
3) якісна реакція (демонстрація):
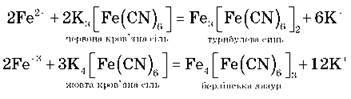
2. Сполуки Феруму(ІІ)
Ферум(ІІ) оксид FeO – основний, твердий, нерозчинний у воді.
Ферум(ІІ) гідроксид Fe(OH)2 – основний, твердий, зеленуватого кольору, нерозчинний у воді.
Утворюється в результаті дії лугів на розчинні солі.
Демонстрація 5
FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl
На повітрі окислюється:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 – бурий осад
Розчинний у кислотах:
Fe(OH)2 + HCl 
Завдання 3. Запишіть рівняння в іонній формі.
Сполуки Fe2+ легко окислюються киснем повітря:
Fe2+ – e –  Fe3+
Fe3+
FeSO4 – 7H2O – залізний купорос.
3. Сполуки Феруму(ІІІ)
Fe2O3 – амфотерний оксид коричневого кольору, твердий, нерозчинний у воді.
Fe(OH)3 – амфотерна основа бурого кольору, нерозчинна у воді.
Демонстрація 5
Одержують ферум(ІІІ) гідроксид дією лугів на розчини солей Fe3+:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl – бурий осад
Осад розчинний і в кислотах, і в надлишку лугу:
Fe(OH)3 + HCl 
Fe(OH)3 + NaOH 
Рівняння реакції записати в молекулярній та іонній формах.
Солі Fe3+ значною мірою гідролізуються, буре забарвлення Fe(OH)3 надає їм коричневого відтінку:
Fe3+ + H2O = FeOH2+ + H+
FeOH2+ + H2O = Fe(OH)2+ + H+
Fe(OH)2+ + H2O = Fe(OH)3 + H+
4. Нерозчинні основи й солі Феруму
Нерозчинні основи й солі Феруму(ІІ) й Феруму(ІІІ) розкладаються в процесі нагрівання.
Завдання 4. Допишіть рівняння:
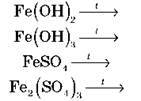
5. Узагальнення вчителя, заповнення опорної схеми
IV. Самостійна робота
Завдання 5. Здійсніть перетворення:
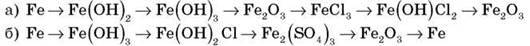
Рівняння 3 запишіть у іонній формі. Рівняння розберіть як ОВР.
V. Підбиття підсумків уроку, оцінювання роботи учнів
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання. Повторити правила техніки безпеки, підготуватися до практичної роботи.