Гальванічні елементи – Електрохімія
ОКИСНЕННЯ І ВІДНОВЛЕННЯ
3. Електрохімія
Окисно-відновні реакції можна використовувати в техніці. У цьому випадку перехід електронів між окисно-відновними парами здійснюється по електричному провіднику і є електричним струмом. Частина зміни ентальпії реакції перетворюється на електричну енергію.
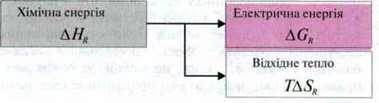
3.1. Гальванічні елементи
Якщо цинкову й мідну пластинку помістити в розведену сульфатну кислоту, то між двома металами можна буде виміряти електричну напругу. Якщо обидві пластинки з’єднати електричним провідником з приладом, то по провіднику піде електричний струм.
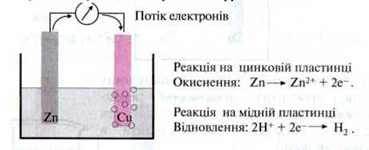
Процес проходить як при контактній корозії, проте обидва “партнери” відокремлені один від одного. Потік електронів по електричному провіднику можна використовувати як носій енергії.
Запам’ятайте: цей принцип перетворення хімічної енергії в електричну використовують в електричній батареї.
Related posts:
- Електрохімічний ряд напруг металів – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.2. Електрохімічний ряд напруг металів Щоб використовувати окисно-відновну реакцію, яка проходить між металом і іонами менш активного металу, для отримання електричної енергії, також потрібно провести просторове розділення “партнерів” окисно-відновної реакції. Приклад. Якщо пластинку заліза помістити в розчин, що містить іони Феруму, а мідну пластинку в розчин, який містить іони Купруму, […]...
- Роль електроліту – Батареї – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.3. Батареї Батарея складається з трьох частин: – негативний електрод, що віддає електрони при проходженні струму, тобто окислюється; – позитивний електрод, що отримує електрони при проходженні струму, тобто відновлюється; – електроліт, який має хорошу електричну провідність і тому забезпечує низький / внутрішній опір батареї. Приклад. Широко вживана батарея – лужна […]...
- Гальванічні елементи 7. Електрика 7.8. Джерела струму 7.8.1. Гальванічні елементи Гальвані Луїджі (1737-1798 рр.) – італійський анатом і фізіолог, один із засновників вчення про електрику, наприкінці 1780 року професор анатомії у Болоньї. Незалежно від нього італійський вчений Олександр Вольт (17451827 рр.) створив джерело постійного струму – гальванічний елемент. У гальванічному елементі відбуваються хімічні реакції, і внутрішня енергія, […]...
- СКЛАДАННЯ РІВНЯНЬ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ З ВИКОРИСТАННЯМ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ СКЛАДАННЯ РІВНЯНЬ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ З ВИКОРИСТАННЯМ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ Окисник – речовина, що містить елемент, у якого в ході реакції ступінь окиснення знижується внаслідок прийому електронів; процес приєднання електронів називається відновленням. Відновник – це речовина, що містить елемент, у якого в ході реакції […]...
- Зміна ступеню окиснення – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.5. Зміна ступеню окиснення Процес віддачі електронів атомом, молекулою або йоном називають окисненням. Атоми, молекули або йони, що віддають електрони, називають відновниками. Під час реакцій вони окислюються: Процес приєднання електронів атомом, молекулою або йоном називають відновленням. Атоми, молекули або йони, […]...
- ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Окисно-відновні реакції проходять за рахунок переходу електронів або атомів від одних частинок до інших. У реакції Відбувається перехід електронів від атомів заліза (відновник) до іонів Купруму (окисник). В реакції Відбувається перехід атомів Оксигену від іонів СlO – (окисник) до йонів SO32- […]...
- Рівновага в окисно-відновних реакціях – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції Окисно-відновна реакція складається з двох напівреакцій: напівреакції окиснення і напівреакції відновлення. Окиснення – це віддача електронів, відновлення – отримання електронів. Приклад. При згоранні магнію атоми Магнію окислюються, а молекули кисню відновлюються. При цьому кожен атом Магнію віддає два електрони кожному атому Оксигену. 1.1. Рівновага в окисно-відновних реакціях На відміну […]...
- Контактна корозія – Корозія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 2 . Корозія 2.3. Контактна корозія Процеси контактної корозії відбуваються там, де два різні метали знаходяться у безпосередньому контакті між собою і стикаються з розчином електроліту або середовищем, що містить кисень. У цьому випадку між ними виникає так званий локальний гальванічний елемент. При цьому корозії піддається метал, який в окисно-відновному ряді має […]...
- ПАЛИВНИЙ ЕЛЕМЕНТ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ПАЛИВНИЙ ЕЛЕМЕНТ Паливний елемент – гальванічний елемент, у якому окисно-відновна реакція підтримується безперервною подачею реагентів (окисника і відновника) та видаленням продуктів реакції. У воднево-кисневому елементі (рис. 40) в електричну енергію перетворюється енергія хімічної реакції Рис. 40. Схема паливного елемента. Електроліт – розчин лугу. […]...
- Рівняння окисно-відновної реакції – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції 1.3. Рівняння окисно-відновної реакції Дуже часто важко скласти рівняння окисно-відновної реакції, якщо невідомо, як саме реагують речовини одна з одною. Використовуючи ступінь окиснення елементів, цю проблему можна вирішити. Перед складанням рівняння окисно-відновної реакції потрібно знати наступне: – який продукт окиснення і продукт відновлення утворюється; – чи проходить реакція в […]...
- Внутрішній опір і термін придатності батарей – Батареї – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.3. Батареї Внутрішній опір і термін придатності батарей Батарея є електричним пристроєм і тому як будь-який інший пристрій має електричний опір, так званий внутрішній опір. Якщо до батареї підключити споживач, наприклад, лампу, то на неї подається не повна напруга джерела, а зменшена напруга на контактах (клемах). Uкл = U0 – […]...
- Заряджання акумулятора – Акумулятори – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.4 . Акумулятори Заряджання акумулятора Якщо до полюсів розрядженого акумулятора прикласти постійну напругу, то окисно-відновна реакція проходитиме в зворотному порядку: – на електроді акумулятора, сполученого з негативним полюсом зарядного пристрою, плюмбум сульфат відновлюється в металічний свинець; – на електроді акумулятора, з’єднаного з позитивним полюсом зарядного пристрою, плюмбум сульфат окислюється, перетворюючись […]...
- Складання рівнянь окисно-відновних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.6. Складання рівнянь окисно-відновних реакцій Для складання рівнянь окисно-відновних реакцій використовують метод електронного балансу. Він грунтується на положенні, що загальна кількість електронів, які віддає відновник, має дорівнювати загальній кількості електронів, які приєднує окисник. Розгляньмо основні етапи написання окисно-відновних реакцій на […]...
- Теорія окисно-відновних реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.1. Теорія окисно-відновних реакцій Усі хімічні реакції можна розділити на два типи. До першого належать реакції, які відбуваються без зміни ступеня окиснення атомів, що входять до складу реагуючих речовин. Наприклад: +1 +5 -2 +1 -2 +1 […]...
- Киснева корозія – Корозія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 2 . Корозія 2.2. Киснева корозія Залізо – один із найважливіших матеріалів, який, на жаль, має здатність іржавіти на вологому повітрі. На першому етапі в процесі окисно-відновної реакції залізо окислюється, а кисень повітря відновлюється. Окиснення: Відновлення: Іони Феруму, що утворюються під час окисно-відновної реакції і гідроксид-іони рухливі та вступають у реакцію між […]...
- IОННО-ЕЛЕКТРОННИЙ МЕТОД СКЛАДАННЯ РІВНЯНЬ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ IОННО-ЕЛЕКТРОННИЙ МЕТОД СКЛАДАННЯ РІВНЯНЬ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ Іонно-електронний метод – це метод напівреакцій. Наприклад: Кількість молів приєднаних електронів дорівнює кількості молів втрачених електронів:...
- Окисно-відновні реакції. Метод електронного балансу Хімія Загальна хімія Окисно-відновні реакції. Метод електронного балансу Реакції, які відбуваються зі зміною ступенів окиснення елементів реагуючих речовин, називаються окисно-відновнимИ. Атоми, які під час утворення хімічних зв’язків у сполуці “приймають” електрони від інших менш електронегативних атомів, називаються окисникамИ. Процес “прийому” електронів називається відновленняМ. Атоми, які під час утворення хімічних зв’язків у сполуці “віддають” електрони іншим […]...
- НАПРЯМОК ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ У РОЗЧИНІ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ НАПРЯМОК ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ У РОЗЧИНІ Для кількісної характеристики окисно-відновних можливостей речовин, що знаходяться в розчинах або стикаються з ними, використовують електродні (окисно-відновні) потенціали Е. Взаємозв’язок ΔG і Е виражається рівнянням Де n – число молів електронів, переданих у процесі; F = 96 485 […]...
- ОКИСНЕННЯ – ВІДНОВЛЕННЯ Хімія – універсальний довідник ГАЛОГЕНИ ОКИСНЕННЯ – ВІДНОВЛЕННЯ Суть реакції між металом і галогеном полягає у втраті електронів атомами одного елемента (у даному випадку металу) і приєднанні цих електронів атомами іншого елемента (галогену). Такі реакції називаються окисно-відновними. Процес віддачі електронів називається окисненням; процес приєднання електронів – відновленням. Речовина, що приймає електрони, називається окисником; речовина, що […]...
- Розрядження акумулятора – Акумулятори – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.4 . Акумулятори Акумулятор – це електрохімічний елемент, який після використання можна знову зарядити і, відповідно, використовувати багато разів. Щоб електрохімічний елемент можна було заряджати, продукти, що утворюються при розрядженні, не повинні розчинятися в електроліті, а залишатися на електродах. Приклад. Найпоширеніший акумулятор – свинцевий акумулятор, що використовують в автомобілях. Напруга […]...
- Окисно-відновні реакції, їх значення Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 27 Тема уроку. Окисно-відновні реакції, їх значення Цілі уроку: розширити знання учнів про хімічні реакції на прикладі окисно-відновних; закріпити навички складання хімічних рівнянь на прикладі найпростіших окисно-відновних реакцій, застосування методу електронного балансу для розміщення коефіцієнтів у рівняннях хімічних реакцій, що протікають зі зміною ступеня окиснення. Тип уроку: узагальнення й систематизації […]...
- ЕЛЕКТРОЛІЗ ВОДИ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ЕЛЕКТРОЛІЗ ВОДИ Електроліз води – окисно-відновний процес розкладу води з утворенням водню і кисню. На катоді відбувається відновлення води з утворенням іонів ОН – і молекул Н2: На аноді здійснюється окиснення води з утворенням молекул О2 і іонів Н+: Дія електричного струму призводить […]...
- Типи окисно-відновних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.7. Типи окисно-відновних реакцій Розрізняють 3 типи окисно-відновних реакцій: міжмолекулярні, внутрішньо-молекулярні та реакції диспропорціонування. 1. Міжмолекулярні окисно-відновні реакції У таких реакціях елемент, що віддає електрони, та елемент, що їх приєднує, містяться в складі різних молекул. Наприклад: 2. Внутрішньо-молекулярні окисно-відновні реакції […]...
- Окисно-відновні реакції Тема 4 ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ УРОК 64 Тема. Окисно-відновні реакції Цілі уроку: поглибити знання учнів про ступінь окиснення на прикладі окисно-відновних реакцій; розвивати навички написання хімічних рівнянь на прикладі найпростіших окисно-відновних реакцій; відпрацювати навички й уміння визначати ступені окиснення атомів хімічних елементів за хімічною формулою. Тип уроку: узагальнення й систематизації знань, умінь і […]...
- Ступінь окиснення – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції 1.2. Ступінь окиснення Водень і хлор реагують під час яскраво вираженої екзотермічної реакції, перетворюючись на гідроген хлорид: Н2 + Сl2 → 2НСl. Ця реакція також окисно-відновна, хоча в цьому випадку, власне, переходу електронів не відбувається. У молекулі гідроген хлориду атом Гідрогену зв’язаний з атомом Хлору спільною парою електронів. Щоб […]...
- Окисно-відновні реакції – ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Окисно-відновні реакції За зміною ступенів окиснення елементів, що входять до складу реагентів та продуктів реакції, усі хімічні реакції можна розділити на дві групи, а саме на: 1) Реакції, що протікають без зміни ступенів окиснення всіх елементів. До таких реакцій належать, зокрема, […]...
- Корозія металів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.4. Корозія Металів Корозія (від лат. corrosio – роз’їдання) – це самовільний процес руйнування металів при взаємодії з навколишнім середовищем. Розрізняють кілька видів корозії, з яких найважливішими є […]...
- ГАЛЬВАНІЧНИЙ ЕЛЕМЕНТ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ГАЛЬВАНІЧНИЙ ЕЛЕМЕНТ Гальванічний елемент – хімічне джерело струму за рахунок здійснення окисно-відновної реакції. (Хімічна енергія системи перетворюється на електричну). Дія гальванічного елемента грунтується на просторовому поділі процесів окиснення і відновлення між двома компонентами, які не торкаються один одного, – металом і розчином солі […]...
- Загальна характеристика – Урок 4 – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.1. Загальна характеристика До складу головної підгрупи V групи1 входять Нітроген N, Фосфор Р, Арсен As, Стибій Sb і Вісмут Ві. Будова зовнішнього електронного шару елементів – ns’2np3. Це p-елементи: Валентність Нітрогену […]...
- САМОСТІИНИЙ РОЗРЯД Фізика підготовка до ЗНО комплексне видання ЕЛЕКТРОДИНАМІКА 3. ЕЛЕКТРИЧНИЙ СТРУМ У РІЗНИХ СЕРЕДОВИЩАХ 3.3. ЕЛЕКТРИЧНИМ СТРУМ У ГАЗАХ (ГАЗОВИЙ РОЗРЯД) 3.3.1. САМОСТІИНИЙ РОЗРЯД Самостійний розряд відбувається внаслідок іонізації електронним ударом (рис. 35) та електронної емісії. Рис. 35 При виникненні самостійного розряду кінетична енергія електронів, які прискорюються електричним полем, переважає роботу виходу електронів із атомів. Число […]...