Іонні рівняння реакцій – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ
Іонні рівняння реакцій
Оскільки електроліти в розчинах утворюють іони, то для відображення змісту реакцій часто використовують так звані іонні рівняння, тому що в розчинах відбуваються реакції не між молекулами, а між іонами. Реакції, чиїм змістом є обмін іонами між реагентами, називають реакціями іонного обміну. У цьому розділі будуть розглядатися тільки реакції обміну в розчинах, що відбуваються без зміни ступеня
Складання іонних рівнянь реакцій
При складанні іонних рівнянь реакцій слід дотримуватися такого алгоритму:
1. Скласти молекулярне рівняння реакції (усі речовини – реагенти й продукти – записують у вигляді молекул) і розставити в ньому коефіцієнти:

2. Скласти повне іонне рівняння реакції. Для цього замість запису молекул усіх речовин, які є сильними електролітами, слід записати іони, у вигляді яких вони існують у розчинах, з урахуванням розставлених коефіцієнтів. Так, у даному разі сильними електролітами є всі речовини, окрім води. Тому замість молекули
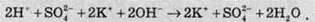
3. Скласти скорочене іонне рівняння реакції (іноді його називають іонно-молекулярним рівнянням реакції). Для цього в повному іонному рівнянні необхідно скоротити в лівій і правій частинах рівняння однакові іони. У нашому випадку однаковими є іони SO42- та К+. Одержуємо:
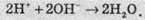
У разі потреби можна ще скоротити кратні коефіцієнти в рівнянні:
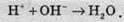
Умови протікання реакцій обміну в розчинах
Протилежно заряджені іони в розчинах притягуються й можуть утворювати продукти реакції. Згідно із теорією дисоціації, можливі два варіанти протікання реакцій обміну в розчинах:
А) утворювані речовини – сильні електроліти, добре розчинні у воді й повністю дисоціюються на іони;
Б) одна (або кілька) з утворюваних речовин – газ, осад (речовина, яка погано розчиняється у воді) або слабкий електроліт (добре розчинний у воді).
Розгляньмо перший випадок – взаємодію натрій хлориду та калій сульфату – і запишімо молекулярне та іонне рівняння із цими речовинами:
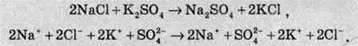
І натрій сульфат, і калій хлорид є добре розчинними сполуками й сильними електролітами, тому в цьому разі при складанні скороченого іонного рівняння всі іони скорочуються. Це свідчить про те, що при змішуванні розчинів натрій хлориду та калій сульфату реакція не відбувається, а утворюється суміш іонів Na+, К+, Сl – і SO42-.
Другий випадок розгляньмо на прикладі двох реакцій:
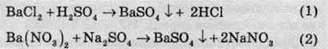
У іонній формі рівняння (1) та (2) матимуть такий вигляд:
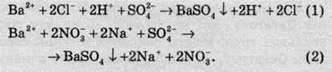
Барій сульфат є практично нерозчинним і вилучається зі сфери реакції, тому його записують у молекулярній формі. Однакові іони в обох частинах рівнянь скорочуються, й обидва рівняння перетворюються на однакові скорочені іонні рівняння:

Очевидно, що при взаємодії інших сульфатів з будь-якою розчинною сіллю Барію реакція буде описуватися таким самим скороченим іонним рівнянням. Отже, іонне рівняння, на відміну від молекулярного, належить не до однієї якої-небудь реакції між конкретними речовинами, а до цілої групи аналогічних реакцій.
Таким чином, якщо в результаті реакції одна з речовин вилучається зі сфери реакції, то реакція обміну відбувається повністю. Це можливо, якщо одним із продуктів реакції є: 1) слабко-розчинний газ, який виділяється з розчину; 2) слабко-розчинна речовина, що випадає в осад; 3) слабко-дисоційована речовина (слабкий електроліт) – слабкі кислоти, вода. У іншому разі реакція не відбувається, а утворюється суміш іонів.
Напрямок протікання реакції
Виходячи з викладеного вище матеріалу, можна зробити висновок, що іонні реакції в розчинах відбуваються до кінця в бік утворення опадів, газів та слабких електролітів. Однак слід підкреслити, що до цього правила не можна ставитися формально. По-перше, слід наголосити на тому, що це правило діє тільки для реакцій між іонами (тобто в реакціях іонного обміну), але не для окисно-відновних реакцій. По-друге, усі три описані випадки можна узагальнити й сказати, що реакції іонного обміну відбуваються в тому разі, якщо один із продуктів реакції вилучається зі сфери взаємодії. У більшості випадків це відповідає утворенню газу, осаду та слабкого електроліту в розчині. Однак слід обов’язково звернути увагу на ще один випадок, який, будучи винятком, тільки підтверджує правило.
Розгляньмо реакцію між розчинами натрій хлориду та сульфатною кислотою:
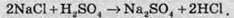
Оскільки всі вихідні речовини и речовини, які утворюються у цій реакції, добре розчинні і є сильними електролітами, то, хоч взаємодія між протилежно зарядженими частинками й спостерігається, вона не приводить до утворення нових речовин. Тому іонне рівняння матиме вигляд:
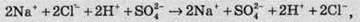
З якого видно, що в розчині до и після змішування перебувають тільки іони Na+, Н+, Сl – і SO42-. Отже, можна зробити висновок, що в даному разі реакція практично не відбувається. Але це не завжди так.
Якщо ж реакцію проводити в умовах нестачі розчинника, тобто натрій хлорид узяти не у вигляді розчину, а в сухому виді, і сульфатну кислоту у вигляді концентрованого розчину, то реакція не буде оборотною. Хлороводень, хоча й добре розчиняється у воді, проте обмежено. І в тому разі, коли розчинника дуже мало, відповідно, й кількість хлороводню, який може в ньому розчинитися, зовсім незначна, а надлишок починає виділятися у вигляді газу, значить, виводиться з реакційного середовища, тобто реакція відбувається практично до кінця. За допомогою рівняння цей процес можна подати в такому вигляді:

Аналогічна ситуація спостерігається й у випадку концентрованих (а ще краще – насичених) розчинів солей. Розгляньмо взаємодію натрій нітрату та калій хлориду:
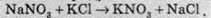
В іонному вигляді реакція виглядає цілком неможливою:
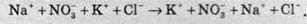
Однак якщо для взаємодії взяти насичені розчини цих солей, то картина принципово міняється. З усіх речовин, що перебувають у рівновазі (NaNO3, KCl, KNO3, NaCl) нижче 22 °С, найнижча розчинність у калій нітрату, а при температурі +30 °С і вище найменша розчинність у натрій хлориду. Тому при змішуванні гарячих розчинів дійсно спостерігається рівновага між іонами, однак зі зниженням температури починають випадати кристали натрій хлориду, як найменш розчинного. У лабораторній практиці для добування калій нітрату беруть еквівалентні кількості NaNО3 і КСl, розчиняють у гарячій воді й викристалізовують натрій хлорид при температурі понад +30 °С. При цьому рівновага зміщується вправо, тобто

Після відділення кристалів натрій хлориду отриманий розчин охолоджують до температури, нижчої за +22 °С, для кристалізації калій нітрату.
Як приклад також можна навести реакцію, що лежить в основі виробництва соди методом Сольве: 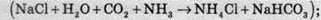 амоній хлорид добре розчинний у воді, а натрій гідрогенкарбонат при охолодженні насиченого розчину відносно мало розчинний у воді.
амоній хлорид добре розчинний у воді, а натрій гідрогенкарбонат при охолодженні насиченого розчину відносно мало розчинний у воді.
Таким чином, процеси, оборотні в певних умовах (розведені розчини), за інших умов (гарячі або охолоджені насичені розчини) можуть стати необоротними внаслідок випадання осаду чи виділення газу. Отже, сформульоване вище правило слід застосовувати на практиці тільки з урахуванням цієї обставини.