Іонний зв’язок – Типи хімічного зв’язку
ХІМІЧНИЙ ЗВ’ ЯЗОК
2. Типи хімічного зв’язку
При утворенні хімічного зв’язку атоми, що беруть участь у ньому, намагаються набути конфігурації інертного газу. Оскільки при цьому задіяні лише оболонки валентних електронів, то для зображення атома використовують так звану формулу Льюїса, в якій зображені лише валентні електрони.
Приклад. Зображення електронної будови атома Натрію і атома Хлору та їх запис у вигляді формули Льюїса
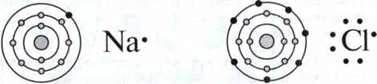
Відповідно, в зображенні враховуються лише ті орбіталі, електрони
Увага: для опису хімічного зв’язку використовують як формулу Льюїса, так і зображення орбіталей.
2.1. Іонний зв’язок
Аби створити конфігурацію інертного газу, оболонка валентних електронів атома може втрачати або приймати електрони. При цьому утворюються позитивно або негативно заряджені іони.
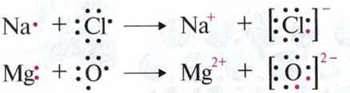
Між іонами, що мають різні заряди, відбувається сильна електростатична взаємодія. Тому іонні сполуки в твердому стані утворюють стійку іонну кристалічну гратку.
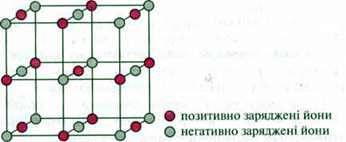
Запам’ятайте: усі солі,
Приклад. Натрій хлорид має температуру плавлення 801 °С, магній оксид – температуру плавлення 2832 °С.
Related posts:
- Структура молекулярних граток речовин – Ковалентний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.3. Ковалентний зв’язок Структура молекулярних граток речовин Молекулярні речовини утворюють у твердому агрегатному стані молекулярну гратку. На відміну від іонної гратки між молекулами в молекулярній решітці існують лише слабкі вандерваальсові зв’язки. Запам’ятайте: усі неметали, оксиди неметалів, безводні кислоти й органічні речовини у твердому стані утворюють молекулярну гратку. Через […]...
- Водневий зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.4 . Водневий зв’язок У молекулах атоми Гідрогену крім електронної пари не мають інших електронів. Ядро атома Гідрогену (протон) дуже мале, тому густина позитивного заряду дуже велика. Якщо атоми Гідрогену утворюють молекули з найбільш електронегативними атомами, то зв’язуюча електронна пара значно відтягнута від протонів. Тому на зовнішнє оточення […]...
- Металічний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.2. Металічний зв’язок Слабо електронегативні атоми металів мають велику здатність віддавати електрони і ставати позитивними іонами. Тому вони формують металічні гратки без участі негативних іонів. Валентні електрони, віддані атомами металу, оточують позитивно заряджені іони металу й утримують гратку електростатичними силами. Запам’ятайте: у металічному зв’язку, на відміну від інших […]...
- Гібридизація орбіталей – Ковалентний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.3. Ковалентний зв’язок Гібридизація орбіталей Виходячи з конфігурації електронів, атом Карбону мав би бути двовалентним, утворюючи зв’язки в результаті перекривання двох напівзайнятих 2р-орбіталей з орбіталями інших атомів. Проте це не так: – Карбон у своїх сполуках найчастіше є чотиривалентним. – У молекулі метану є чотири ідентичні зв’язки, які […]...
- Ковалентний полярний і неполярний зв’язок, іонний зв’язок. Електронні формули молекул речовин Тема 4 ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ УРОК 58 Тема. Ковалентний полярний і неполярний зв’язок, іонний зв’язок. Електронні формули молекул речовин Цілі уроку: закріпити знання про види хімічного зв’язку; розвивати навички написання електронних формул речовин, уміння визначати вид хімічних зв’язків у молекулах за будовою атомів, що утворюють цю молекулу. Тип уроку: засвоєння знань, умінь і […]...
- Умови виникнення хімічного зв’язку Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ Умови виникнення хімічного зв’язку Хімічний зв’язок – це взаємодія атомів, здійснювана шляхом обміну електронами або їхнім переходом від одного атома до іншого. Не всі атоми можуть взаємодіяти між собою. Буває так, що при зближенні атомів та перекриванні їхніх […]...
- Кратні зв’язки – Ковалентний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.3. Ковалентний зв’язок Формування ковалентного зв’язку відбувається також за правилом октету. Атоми з’єднуються в молекули і при цьому намагаються шляхом утворення спільних електронних пар сформувати стійку конфігурацію інертного газу. Розрізняють два випадки утворення ковалентного зв’язку: – кожен атом віддає один електрон для спільної електронної пари; – один атом […]...
- ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. БУДОВА АТОМА Й ТИПИ ХІМІЧНОГО ЗВ’ЯЗКУ ПОВТОРЕННЯ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ УРОК 2. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. БУДОВА АТОМА Й ТИПИ ХІМІЧНОГО ЗВ’ЯЗКУ Цілі: повторити відомості про будову періодичної системи, будову атома, типи хімічних зв’язків; формувати вміння встановлювати залежність будови атома і властивостей речовин, зображувати схеми утворення хімічних зв’язків. Обладнання: роздавальний матеріал, мультимедійний проектор, […]...
- Вандерваальсова взаємодія (сила) – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.5 . Вандерваальсова взаємодія (сила)1 Водневі зв’язки обумовлені постійною наявністю диполів, вандерваальсові сили виникають при взаємодії короткочасно утворених диполів. Вандерваальсовий зв’язок – найслабший з усіх типів зв’язку. Короткочасний асиметричний розподіл зарядів є тимчасовим диполем. Цей диполь може поляризувати сусідні молекули і тим самим індукувати (лат. inducere – вводити) […]...
- Електронна природа хімічного зв’язку. Поняття про електронегативність Тема 4 ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ УРОК 55 Тема. Електронна природа хімічного зв’язку. Поняття про електронегативність Цілі уроку: ознайомити учнів із причинами виникнення хімічного зв’язку між атомами в процесі утворення простих і складних речовин, типами хімічного зв’язку; розкрити зміст поняття електронегативність та його застосування для визначення типу хімічного зв’язку; поглибити знання про періодичний закон […]...
- ІОННИЙ І КОВАЛЕНТНИЙ ЗВ’ЯЗОК Хімія – універсальний довідник ВІД НАТРІЮ ДО АРГОНУ ІОННИЙ І КОВАЛЕНТНИЙ ЗВ’ЯЗОК Атоми того самого елемента притягують до себе електрони однаково, тому електрони на зв’язучій молекулярній орбіталі між однаковими атомами (у простих речовинах), можна сказати, однаковою мірою належать обом атомам. У цьому випадку кажуть про ковалентний зв’язок. Різні атоми притягують електрони з різною силою, тому […]...
- Іонний зв’язок Тема 4 ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ УРОК 57 Тема. Іонний зв’язок Цілі уроку: розширити знання учнів про будову атомів металів і не – металів на прикладі утворення іонів; ознайомити учнів з механізмом утворення іонного зв’язку; розвивати навички складання електронних формул речовин. Тип уроку: засвоєння нових знань, умінь і навичок. Форми роботи: розповідь учителя, самостійна […]...
- СУТНІСТЬ ХІМІЧНОГО ПЕРЕТВОРЕННЯ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ СУТНІСТЬ ХІМІЧНОГО ПЕРЕТВОРЕННЯ Хімія вивчає перетворення речовин, які супроводжуються зміною їх складу і (або) будови. Наприклад: Суть хімічної реакції – перегрупування атомів, яке супроводжується розривом хімічних зв’язків у вихідних речовинах і утворенням хімічних зв’язків у продуктах реакції. Хімічна реакція супроводжується енергетичними змінами, тому що під час […]...
- СПОЛУЧЕННЯ АТОМІВ МІЖ СОБОЮ. УТВОРЕННЯ ХІМІЧНОГО ЗВ’ЯЗКУ Хімія – універсальний довідник БУДОВА АТОМА СПОЛУЧЕННЯ АТОМІВ МІЖ СОБОЮ. УТВОРЕННЯ ХІМІЧНОГО ЗВ’ЯЗКУ Як і чому відбувається сполучення нейтральних атомів? Почнемо пояснення з найпростішого випадку. Нехай на деякій відстані один від одного (наприклад, 0,1нм) знаходяться два протони – два ядра атома Гідрогену. У чому полягатиме їх взаємодія? Звичайно, вони будуть відштовхуватися, тому що заряджені однойменно. […]...
- Характеристика хімічного елемента за його місцем періодичній системі та будовою атома РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ § 6. Характеристика хімічного елемента за його місцем періодичній системі та будовою атома Усвідомлення змісту цього параграфа дає змогу: Визначати місце хімічного елемента у періодичній системі; пояснювати будову атома хімічного елемента; Характеризувати за місцем елемента у періодичній системі та будовою атома властивості простої речовини, […]...
- ЕНЕРГІЯ (МІЦНІСТЬ) І ДОВЖИНА ХІМІЧНОГО ЗВ’ЯЗКУ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНИЙ ЗВ’ЯЗОК ЕНЕРГІЯ (МІЦНІСТЬ) І ДОВЖИНА ХІМІЧНОГО ЗВ’ЯЗКУ Енергія хімічного зв’язку – це енергія, необхідна для роз’єднання атомів і віддалення їх на таку відстань, на якій вони вже не відчувають сили притягування один до одного. Довжина зв’язку – відстань між ядрами атомів, що утворюють хімічний зв’язок....
- Тема 9. Хімічний зв’язок і будова речовини Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ БУДОВА РЕЧОВИНИ Тема 9. Хімічний зв’язок і будова речовини Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Вкажіть причину, завдяки якій алмаз має високу твердість: A. Складається з атомів Карбону; Б. Має атомну кристалічну гратку; B. Не має забарвлення; Г. […]...
- Іонний зв’язок Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ Іонний зв’язок Утворення іонного зв’язку Іонний зв’язок за механізмом утворення нагадує ковалентний, але має принципову відмінність: у речовинах з іонним зв’язком атоми жорстко не з’єднуються один з одним, а просто притягуються електростатичними взаємодіями. Атоми лужних металів, наприклад Натрію, […]...
- Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку Полярність ковалентного зв’язку У молекулах водню, фтору й фтороводню між атомами утворюється ковалентний зв’язок за рахунок утворення спільної електронної пари. Атоми різних хімічних елементів здатні притягувати валентні електрони інших атомів. […]...
- Зображення орбіталей БУДОВА АТОМА 6 . Хвильова модель 6.2 . Зображення орбіталей Щоб наочно показати конфігурацію електронів атома, Л. Паулі запропонував зображувати його орбіталі у вигляді електронних комірок. Електрони в них зображають вертикальними стрілками. Для розпізнавання спінового квантового числа стрілки направлені у протилежних напрямах. Запам’ятайте: два електрони з протилежним спіном, які знаходяться на одній і тій самій […]...
- Функціональна ізомерія – Типи ізомерії ІЗОМЕРІЯ ОРГАНІЧНИХ РЕЧОВИН 2. Типи ізомерії 2.4 . Функціональна ізомерія Функціональна ізомерія молекул речовин визначається тим, що при однаковій сумарній формулі вони мають різні функціональні групи і, отже, абсолютно різні властивості. Приклад. Речовина етанол і диметиловий етер мають одну й ту саму сумарну формулу – С2Н6O. Етанол змішується з водою в будь-якому співвідношенні і має […]...
- ВПЛИВ ТЕМПЕРАТУРИ НА НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ВПЛИВ ТЕМПЕРАТУРИ НА НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ Згідно з рівнянням На значення ΔG великий вплив має температура. Цей вплив визначається знаком і величиною ΔS. При ΔS > 0 з підвищенням температури (збільшенням Т) негативне значення ΔG буде зменшуватися, а при ΔS < 0 – збільшуватися. Приклад реакції, […]...
- Типи кристалічних решіток ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 3. ХІМІЧНИЙ ЗВ’ЯЗОК § 3.7. Типи кристалічних решіток Тверді речовини, як правило, мають кристалічну будову. Вона характеризується правильним розміщенням частинок у чітко визначених точках простору. При уявному з’єднанні цих точок прямими лініями, що перетинаються, утворюється просторовий каркас, який називають кристалічною решіткою. […]...
- Валентність атомів – Здатність атомів утворювати сполуки ХІМІЧНИЙ ЗВ’ ЯЗОК 1.2 . Валентність атомів Якщо один атом з’єднується з іншим атомом, то залежно від виду атомів утворюються іони або молекули. – При утворенні іонного зв’язку валентні електрони приймаються або віддаються повністю. – При утворенні молекул валентні електрони йдуть на утворення спільних електронних пар. Число хімічних зв’язків за рахунок отриманих або відданих електронів, […]...
- УТВОРЕННЯ ХІМІЧНОГО ЗВ’ЯЗКУ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНИЙ ЗВ’ЯЗОК УТВОРЕННЯ ХІМІЧНОГО ЗВ’ЯЗКУ Хімічний зв’язок здійснюється за рахунок електростатичної взаємодії позитивно заряджених атомних ядер і негативно заряджених електронів. Під час утворення хімічних сполук з атомів виділяється енергія....
- Оптична ізомерія – Типи ізомерії ІЗОМЕРІЯ ОРГАНІЧНИХ РЕЧОВИН 2. Типи ізомерії 2.6. Оптична ізомерія При проходженні променя поляризованого світла через водні розчини деяких речовин площина поляризації світла повертається (довкола осі променя) на кут, пропорційний довжині шару оптично активної речовини. Єдиною причиною обертання площини поляризації світла може бути асиметрія молекул. Просторові ізомери – антиподи – обертають площину поляризації на один і […]...
- ДОНОРНО-АКЦЕПТОРНИЙ МЕХАНІЗМ УТВОРЕННЯ ХІМІЧНОГО ЗВ’ЯЗКУ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНИЙ ЗВ’ЯЗОК ДОНОРНО-АКЦЕПТОРНИЙ МЕХАНІЗМ УТВОРЕННЯ ХІМІЧНОГО ЗВ’ЯЗКУ Згідно з донорно-акцепторним механізмом ковалентний зв’язок утворюється за рахунок взаємодії частинок, одна з яких має пару електронів – донор, а друга – вільну орбіталь –акцептор:...
- ЕНТРОПІЯ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЕНТРОПІЯ Ентропію можна охарактеризувати, як ступінь безладдя (невпорядкованості) системи. Ентропію речовини прийнято відносити до стандартних умов: до тиску р = 101 325 Па (1 атм) і, зазвичай, до температури 298 К (25 °С). Ентропія 1 моль речовини у стандартному стані називається стандартною молярною ентропією. Її позначають […]...
- ЕНТАЛЬПІЙНИЙ І ЕНТРОПІЙНИЙ ФАКТОРИ І НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЕНТАЛЬПІЙНИЙ І ЕНТРОПІЙНИЙ ФАКТОРИ І НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ Згідно з рівнянням Можливість реакції Визначає ентальпійний фактор: ΔH < 0. Можливість реакції Визначає ентропійний фактор: TΔS > 0. Реакція протікає за високої температури....
- КЛАРК (ХІМІЧНОГО ЕЛЕМЕНТА) Екологія – охорона природи КЛАРК (ХІМІЧНОГО ЕЛЕМЕНТА) – числова оцінка середнього вмісту хім. елемента в земній корі, літосфері, гідросфері, атмосфері, біосфері, живій речовині, Землі загалом, у різних гір. породах, косм. об’єктах тощо. К. виражаються в одиницях маси (%, г/т та ін.) або в атомних відсотках....