Корозія металів – ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ
Корозія металів
Корозією зазвичай називають мимовільне руйнування металів у результаті їхньої хімічної й електрохімічної взаємодії із зовнішнім середовищем та перетворення їх у стійкі сполуки (оксиди, гідроксиди, солі).
Власне кажучи, корозія являє собою сукупність окисно-відновних процесів, які відбуваються при контакті металів з агресивним середовищем, що призводить до руйнування металевих виробів. Під
За механізмом процесу розрізняють хімічну та електрохімічну корозію металів. Хімічна корозія являє собою звичайну хімічну реакцію між атомами металів і різних окисників. Прикладами хімічної корозії є високотемпературне окиснення металів киснем, окиснення поверхні алюмінію на повітрі, взаємодія металів із хлором, сіркою, сірководнем H2S тощо.
Електрохімічна корозія протікає в розчинах, тобто, в основному, при контакті металів з розчинами
Причина корозії металів
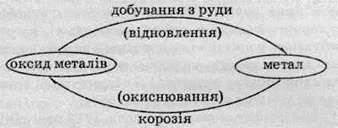
Багато металів, зокрема й Ферум, перебувають у земній корі у вигляді оксидів. Перехід від металу до оксиду – енергетично вигідний процес, інакше кажучи, оксиди більш стійкі сполуки, ніж метали. Для того щоб провести зворотний процес і добути метал з руди, необхідно затратити багато енергії, тому залізо виявляє тенденцію перетворюватися знову в оксид – як кажуть, залізо іржавіє. Іржавіння – це термін для позначення корозії, тобто процесу окиснення металів під дією навколишнього середовища.
Кругообіг металів у природі можна зобразити за допомогою такої схеми:
Металеві вироби іржавіють тому, що сталь, з якої вони зроблені, реагує з киснем та водою, котрі містяться в атмосфері. При корозії заліза або сталі утворюються гідратовані форми ферум(ІІІ) оксиду різного складу (Fe2О3 ∙ хН2О). Оксид проникний для повітря та води й не утворює захисного шару на поверхні металу. Тож корозія металу продовжується й під шаром іржі, що утворилася.
Коли метали контактують із вологим повітрям, вони завжди підлягають корозії, однак на швидкість іржавіння впливає дуже багато факторів. З-поміж них можна назвати такі: наявність домішок у металі; присутність кислот або інших електролітів у розчинах, що стикаються з поверхнею заліза; кисень, який міститься в цих розчинах.
Механізм електрохімічної корозії металевої поверхні
У більшості випадків корозія являє собою електрохімічний процес. На поверхні металу утворюються електрохімічні комірки, в яких різні ділянки діють як області окиснення та області відновлення.
Нижче наведені дві напівреакції окисно-відновного процесу іржавіння:
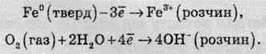
Сумарне рівняння реакції корозії заліза можна записати так:
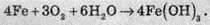
Схематично процеси, які відбуваються на поверхні заліза або сталі при контакті з водою, можна подати так:
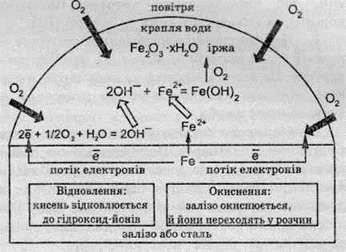
Концентрація кисню, розчиненого в краплі води, визначає те, які області на поверхні металу є місцем відновлення, а які – місцем окиснення.
По краях краплі, де концентрація розчиненого кисню вища, кисень відновлюється до гідроксид-іонів.
Необхідні для відновлення кисню електрони переміщаються із центра краплі, де вони вивільняються при окисненні Феруму й де концентрація розчиненого кисню мала. Іони Феруму переходять у розчин. Вивільнювані електрони по поверхні металу переміщаються до країв краплі.
Сказане вище пояснює, чому корозія найбільшою мірою проявляється в центрі краплі води або під шаром фарби: це області, в які надходження кисню обмежене. Тут утворюються так звані “раковини”, в яких Ферум переходить у розчин.
Іржа як така виникає в результаті послідовності вторинних процесів у розчині, куди дифундують із поверхні металу іони Феруму та гідроксид-іони. Захисний шар на поверхні не утворюється.
Активність протікання реакції відновлення Оксигену залежить від кислотності середовища, тому в кислому середовищі корозія прискорюється. Будь-які примісні солі, наприклад, натрій хлорид у бризах морської води, сприяють утворенню іржі, оскільки збільшують електропровідність води.
Можливо, проблему корозії ніколи не вдасться розв’язати повністю, і найбільше, на що можна розраховувати,- це уповільнити її, але не зупинити.
Методи захисту від корозії
На сьогодні існує кілька способів запобігання корозії.
Відокремлення металу від агресивного середовища – фарбування, змащування маслами, покриття неактивними металами або емаллю (І), Приведення поверхні металів у контакт із більш активними металами (II). Використання речовин, що сповільнюють корозію (інгібітори корозії), та сплавів, стійких до корозії (III).
I. Найпростіший спосіб захистити сталь від корозії – це ізолювати метал від атмосферного повітря. Це можна зробити за допомогою масляного, жирового змащування або нанесення захисного шару фарби.
Зараз широко застосовують захисні покриття з органічних полімерів. Покриття можна робити різних кольорів, і це досить гнучке розв’язання проблеми корозії. Навіть побіжний погляд на речі, які оточують нас у побуті, дає масу прикладів такого розв’язання: холодильник, сушарка для посуду, піднос, велосипед тощо.
II. Іноді залізо покривають тонким шаром іншого металу. Деякі виробники виготовляють кузови автомобілів зі сталі з гальванічним цинковим покриттям. При такій обробці утворюється міцно зчеплений з основою шар цинк оксиду, і якщо гальванічне покриття не ушкоджене, воно добре захищає від іржі.
Навіть якщо таке покриття має вади, сталевий корпус машини все ж таки захищений від швидкого руйнування, тому що в цій системі переважно кородує цинк, а не залізо, оскільки цинк більш активний метал, аніж залізо. У даному разі цинк приносять у жертву. Одна з найперших пропозицій щодо використання протекторних (“жертовних”) металів була зроблена в 1824 році для захисту від корозії металевої обшивки корпусів морських човнів.
Сьогодні цинкові блоки використовують для захисту від корозії нафтовидобувних платформ у морях: корозія з дорогих складних сталевих конструкцій переводиться на шматки металу, які легко замінити. У чому ж полягає принцип такого захисту? Проілюструємо його за допомогою схеми.
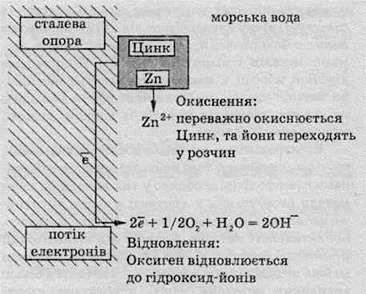
Через певні проміжки вздовж усієї опори, що перебуває в морі, прикріплені цинкові блоки. Оскільки цинк активніший, аніж залізо (розташований лівіше в електрохімічному ряді напруг), то переважно окислюється цинк, а залізна поверхня переважно залишається недоторканою. У принципі, будь-який метал, розташований лівіше заліза в електрохімічному ряді напруг, може бути використаний для захисту сталевих виробів.
Аналогічний принцип використовують для захисту залізобетонних конструкцій житлових будинків, в яких усі залізні прути з’єднані один з одним і з’єднуються зі шматком магнію, заритим у землю.
III. Дуже розповсюдженим розв’язанням проблеми захисту від корозії є використання іржостійких сплавів. Багато зі сталевих виробів, використовуваних у побуті, особливо ті, що перебувають у постійному контакті з водою: кухонний посуд, ложки, виделки, ножі, бак пральної машини тощо – виготовлені з іржостійкої сталі, яка не вимагає додаткового захисту.
Іржостійку сталь винайшов у 1913 році хімік із Шеффілда Гаррі Бріарлі. Він досліджував швидке зношування нарізки збройових стволів і вирішив спробувати сталь із високим вмістом хрому, щоб подивитися, чи не можна в такий спосіб продовжити життя зброї.
Зазвичай при проведенні аналізу сталі зразок розчиняли в кислоті. Бріарлі, проводячи такий аналіз, зіштовхнувся з несподіваними труднощами. Його сталь, із високим вмістом хрому, не розчинялася. Він також помітив, що залишені в лабораторії зразки зберігали первісний блиск. Бріарлі відразу ж зметикував, що він винайшов сталь, стійку до корозії.
Винахід Гаррі Бріарлі наштовхнувся на деякі забобони. Один з головних виробників металевого посуду в Шеффілді вважав саму ідею Бріарлі такою, “що суперечить природі”, а інший заявив, що “стійкість до корозії – не таке вже й велике достоїнство ножів, які за своїм призначенням вимагають чищення після кожного використання”. Сьогодні ми сприймаємо як належне те, що посуд зберігає свій блиск і не піддається дії кислот, які містяться в їжі.
Іржостійка сталь не піддається корозії тому, що на її поверхні утворюється плівка хром(ІІІ) оксиду. На відміну від іржі, на цей оксид не діє вода, і він міцно зчеплений з металевою поверхнею. Маючи товщину всього кілька нанометрів, оксидна плівка невидима для неозброєного ока й не приховує природний блиск металу. При цьому вона непроникна для повітря та води й захищає метал. Більше того, якщо зішкребти поверхневу плівку, вона швидко відновиться.
На жаль, іржостійка сталь дорога, і ми змушені зважати на це при виборі сталі для використовування. У сучасній техніці найчастіше використовують іржостійку сталь такого складу: 74% заліза, 18% хрому, 8% нікелю.
Оскільки використання іржостійкої сталі не завжди економічно виправдане, як і використання захисних шарів змазок та фарб, то сьогодні досить часто використовують покриття залізних виробів тонким шаром цинку (оцинковане залізо) або олова (луджене залізо). Останнє дуже часто використовують при виготовленні консервів.
Метод захисту консервів покриттям внутрішньої металевої поверхні оловом запропонував англієць Пітер Дюранд. Із таким захистом консерви впродовж тривалого часу залишаються придатними для їжі. На жаль, виробництво продуктових консервів та напоїв не позбавлене труднощів. Різні продукти створюють усередині банки різне середовище, яке по-різному діє на метал і може спричинити корозію.
На початку XX століття стали випускати баночне пиво. Однак новий продукт не мав блискавичного успіху, і причиною цього було те, що банки кородували зсередини. Тонкий шар олова, що ним покривали банки, дуже рідко виходив суцільним. Найчастіше він мав незначні вади. У водному розчині залізо окислюється швидше, ніж олово (через більш високу активність). Іони Феруму Fe2+ розчинялися в пиві (яке загалом є непоганим засобом від анемії) і надавали напою присмаку металу, а крім того, зменшували його прозорість. Це знижувало популярність баночного пива. Утім, виробникам вдалося подолати цю проблему після того, як вони стали покривати внутрішність банок спеціальним інертним органічним лаком.
У банках з консервованими фруктами є органічні кислоти, наприклад лимонна кислота. У розчині ці кислоти сприяють зв’язуванню іонів Стануму Sn2+ і тим самим збільшують швидкість розчинення олов’яного покриття, тому в консервованих фруктах (персиках тощо) переважно кородує олово. Іони Стануму, які потрапляють у такий спосіб у їжу, нетоксичні. Вони не змінюють суттєво смакові якості консервованих фруктів, хіба що надають їм гоструватого присмаку. Однак якщо таку банку зберігати занадто довго, можуть виникнути проблеми. Тонкий шар олова, який окислюється, зрештою зруйнується й під впливом органічних кислот почне досить швидко кородувати залізний шар.