Ковалентний зв’язок
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ
Ковалентний зв’язок
Утворення ковалентного зв’язку
При утворенні хімічного зв’язку атоми прагнуть до того, щоб на їхньому зовнішньому енергетичному рівні було два (у випадку з Гідрогеном) або вісім (октет) електронів. Цього можна досягти кількома способами. Найпоширеніший з них полягає в об’єднанні неспарених електронів у спільні електронні пари, які одночасно належать обом атомам.
Хімічний
У найпростішому з відомих атомів – атомі Гідрогену – на зовнішньому електронному рівні перебуває один електрон: при зображенні утворення хімічного зв’язку заведено позначати електрони зовнішнього енергетичного рівня (валентні електрони) крапкою або хрестиком: Н-.
Такі формули називають формулами Льюїса, або електронно-крапковими формулами. За допомогою таких формул утворення молекули Н2 можна записати у вигляді схеми:

Таким чином, кожний атом Гідрогену віддає свій валентний
Спільну електронну пару, яка обумовлює хімічний зв’язок, можна позначити рискою. Таким чином, отримуємо структурну формулу водню:
Н – Н.
Атоми неметалів другого періоду прагнуть доповнити електронну оболонку до октету. Атом Флуору містить на зовнішньому рівні сім електронів – три електронні пари та один неспарений електрон.
До завершення зовнішнього рівня атому Флуору не вистачає одного електрона, тому кожен з атомів віддає в спільне користування по одному неспареному електрону:
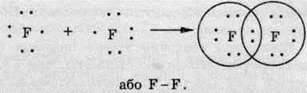
Таким чином, кожний з атомів одержує на зовнішньому рівні по вісім електронів (октет), з яких два перебувають у спільному користуванні, а шість (три пари) не беруть участі в утворенні хімічного зв’язку й належать лише одному атому (неподілені електронні пари).
Утворення подвійного та потрійного зв’язків
При взаємодії двох атомів, кожний з яких має кілька неспарених електронів, утворюється відразу кілька спільних електронних пар. Прикладом може слугувати молекула кисню O2. В атомі Оксигену на зовнішньому рівні перебуває шість електронів: дві електронні пари й два неспарені електрони.
Ці неспарені електрони беруть участь в утворенні двох спільних електронних пар:
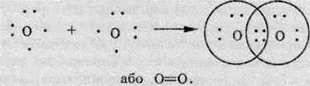
Такий хімічний зв’язок називають подвійним і позначають двома рисками. Зв’язок, утворений однією парою електронів, називають одинарним (або ординарним, тобто звичайним).
В атомах Нітрогену на зовнішньому електронному рівні перебуває три неспарені електрони. Завдяки їм при утворенні молекули азоту N2 утворюються три спільні електронні пари:
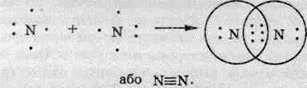
Зв’язок у молекулі азоту називають потрійним.
Утворення зв’язку між різними атомами
У молекулі фтороводню HF атом Гідрогену за рахунок “чужого” електрона завершує перший енергетичний рівень, а атом Флуору F – другий:
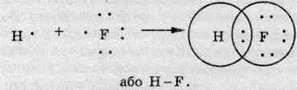
Якщо в одному атомі є кілька неспарених електронів, то він може утворювати ковалентні зв’язки відразу з кількома атомами. У молекулі води атом Оксигену утворює два ковалентні зв’язки з двома атомами Гідрогену:
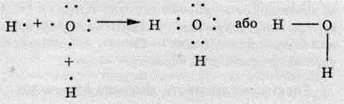
Між атомами різних елементів можуть також утворюватися і подвійні зв’язки. Наприклад, у молекулі вуглекислого газу СO2 між атомами Карбону й Оксигену:
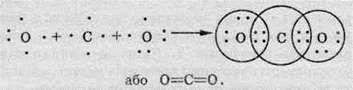
У цьому разі кожний з атомів Оксигену утворює подвійний зв’язок, а атом Карбону – два подвійні зв’язки.