Кристалічні гратки
РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ
§ 8. Кристалічні гратки
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати внутрішню будову твердої речовини; розрізняти типи кристалічних граток;
Пояснювати аморфний стан, будову кристалічних граток різних типів, залежність фізичних властивостей речовин від кристалічної будови й обгрунтовувати її.
Ви вже знаєте, що відносно прості форми організації речовини – атоми, йони, молекули – у стандартних умовах індивідуально не
– Пригадайте з курсу фізики, в якому агрегатному стані можуть існувати речовини і чим ці стани різняться.
Залежно від природи частинок і характеру взаємодії між ними розрізняють певні агрегатні стани.
Тверді речовини можуть перебувати в аморфному і кристалічному станах. Речовини в аморфному стані не мають упорядкованої структури. До них належить багато полімерів, смоли, янтар (бурштин), силіцій, селен тощо. Серед аморфних матеріалів найвідомішим є скло, тому аморфний стан ще називають склоподібним.
У речовин
Кристалічні гратки – це розташування у просторі атомів, молекул, йонів у певному порядку.
На основі різної природи частинок, які містяться у вузлах кристалічних граток, і різних хімічних зв’язків між ними усі кристали поділяються на молекулярні, атомні, йонні та металічні. Залежно від цього й кристалічні гратки поділяють на відповідні типи (мал. 14).
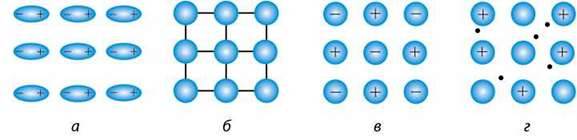
Мал. 14. Типи кристалічних граток: а – молекулярні; б – атомні; в – йонні; г – металічні
Молекулярні кристали. У вузлах молекулярних кристалічних граток (мал. 14, а) містяться молекули (полярні та неполярні), зв’язані між собою слабкими міжмолекулярними силами, зокрема водневими зв’язками. Наприклад, кристали льоду складаються з молекул води, які утримуються в гратці водневими зв’язками, що значно слабкіші за сили ковалентного зв’язку. Тому речовини з молекулярними гратками мають невелику твердість, вони легкоплавкі й леткі. До таких речовин належать кристали йоду, хлору, брому, водню, кисню, азоту, інертних газів, “сухого льоду” СО2, амоніаку NH3, метану СН4 та майже всіх органічних сполук.
Атомні кристали. У вузлах атомних кристалічних граток містяться атоми, сполучені між собою міцними ковалентними зв’язками (мал. 14, б).
Тому речовини з таким типом кристалічних граток характеризуються великою твердістю, дуже високими температурами плавлення і кипіння; вони нелеткі, практично не розчиняються в жодних розчинниках, електричний струм не проводять. Атомні гратки мають лише деякі речовини в твердому стані – алмаз C, силіцій Si, бор В, силіцій(ІV) оксид SiO2, силіцій(ІV) карбід SiC та ін.
Йонні кристали. У вузлах йонних кристалічних граток містяться позитивно і негативно заряджені йони – як прості (Na+, К+, СІ-, S2-),
Так і складні 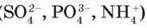 (мал. 14, в). Вони сполучені один з одним
(мал. 14, в). Вони сполучені один з одним
Силами електростатичного притягання. До них належать солі, основні оксиди, гідроксиди. Речовини з йонними гратками мають порівняно високу твердість; вони доволі тугоплавкі, майже нелеткі та крихкі.
Металічні кристали. У вузлах металічних кристалічних граток містяться атоми і позитивно заряджені йони. Між ними – “електронний газ”, розподілений по всьому металу (мал. 14, г). Отже, валентні електрони атомів не локалізовані. Між позитивно зарядженими йонами металічних елементів та нелокалізованими електронами існує електростатична взаємодія. Речовини з металічними гратками – метали – мають різні температури плавлення, здебільшого високі. Вони нелеткі (крім ртуті), тверді, пластичні, ковкі. Мають високу електро – та теплопровідність.
Коротко про головне
Тверді речовини у кристалічному стані складаються з атомів, молекул, йонів, розміщених не хаотично, а в певному порядку, утворюючи кристалічні гратки.
Залежно від характеру частинок, які утворюють кристал, і типу хімічного зв’язку між ними кристалічні гратки поділяються на молекулярні, атомні, йонні, металічні.
Тип кристалічної гратки чітко визначає фізичні властивості речовини. Чим міцніший зв’язок між структурними частинками кристалічної гратки, тим переважно вищі твердість речовини і температура плавлення. Міцними є атомні та металічні гратки, а молекулярні мають незначну міцність і невисокі температури плавлення, особливо якщо у вузлах гратки містяться неполярні молекули.