Магній гідроксид – Металічні елементи головної підгрупи II групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
8. Металічні елементи та їхні сполуки. Метали
8.3. Металічні елементи головної підгрупи II групи1
8.3.4. Магній гідроксид
Магній гідроксид – нерозчинна у воді речовина білого кольору. При нагріванні розкладається:
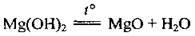
Взаємодіє:
– з кислотними оксидами:
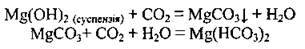
– з кислотами (легко):
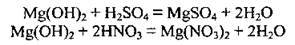
– з амфотерними оксидами (при сплавлянні):
– з амфотерними гідроксидами (при сплавлянні):
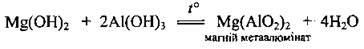
Добування магній гідроксиду
Добувають магній гідроксид дією лугів або аміачною водою на розчини солей Магнію:
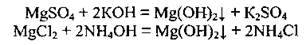
Застосування магнію та його сполук Магній дуже широко використовують як основу у виробництві легких міцних сплавів для космічної та авіаційної промисловості, в автомобіле – та приладобудуванні; у металургії – як відновник для добування деяких металів (наприклад, титану) з їхніх оксидів і галогенідів (магнійтермія):
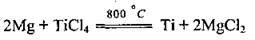
Також його
Яскраве полум’я горіння (у реакції з окисниками) раніше використовували для фотоспалаху, а зараз – у піротехніці.
Магній оксид через низьку теплопровідність і високу температуру плавлення (витримує температуру до 2800 °С) застосовують як вогнетривкий матеріал, теплоізолятор (аналогічно азбест і тальк), для виготовлення деяких видів цементу, а також вогнетривкої кераміки.
Магній перхлорат Mg(ClO4)2 використовують як водопоглинач для осушування газів (кристалогідрат містить шість молекул води).
Великі перспективи мають сполуки Магнію в електротехнічній галузі (у виробництві потужних електричних батарей і сухих елементів).
Related posts:
- Кальцій гідроксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.7. Кальцій гідроксид Кальцій гідроксид (Са(ОН)2). Насичений водний розчин кальцій гідроксиду називають вапняною водою, а білу суспензію кальцій гідроксиду – вапняним молоком. Одержання кальцій гідроксиду У лабораторії Са(ОН)2 одержують […]...
- Магній оксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.3. Магній оксид Магній оксид MgO – основний оксид. З водою не реагує, взаємодіє: – з кислотними оксидами (при нагріванні): – з кислотами: – із солями, витісняючи менш активні […]...
- Магній – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.2. Магній Магній – 12-й елемент періодичної таблиці, заряд ядра – +12. Хімічний символ – Mg, відносна атомна маса – 24. Відомо три стабільні природні ізотопи Магнію: 24Mg (78,6 […]...
- Кальцій оксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.6. Кальцій оксид Кальцій оксид СаО має технічні назви палене вапно, негашене вапно. Кальцій оксид – сполука з яскраво вираженими основними властивостями. Добування кальцій оксиду У лабораторії: А) окисненням […]...
- Загальна характеристика – Урок 2 – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.1. Загальна характеристика Лужноземельні металічні елементи – це s-елементи, які розміщуються у головній підгрупі II групи періодичної системи, а саме: Кальцій (Са), Стронцій (Sr), Барій (Ва), Радій (Ra). Інші […]...
- Солі кальцію – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.8. Солі кальцію Якісне виявлення: іони Са2+ забарвлюють полум’я газового пальника в цегляно-червоний колір. Карбонат амонію осаджує з розчинів солей Кальцію білий осад СаСО3. Гіпс CaSО4 · 2Н2О при […]...
- Оксиди і гідроксиди Натрію та Калію – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.3. Оксиди і гідроксиди Натрію та Калію Оксиди Натрію та Калію – це тверді білі речовини, які виявляють основні властивості, реагуючи – з водою (утворюються луги): – з кислотами: – […]...
- Твердість води – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.9. Твердість води Твердість води зумовлена наявністю розчинних у ній солей. При використанні твердої води витрачається значно більше мийних засобів, утворюється накип на посуді та нагрівальних приладах. Дуже м’яка […]...
- Кальцій – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.5. Кальцій Кальцій – 20-й елемент періодичної таблиці, заряд ядра – +20. Хімічний символ – Са. Відносна атомна маса – 40. Утворює просту речовину – сріблясто-білий метал кальцій. Виявляє […]...
- Натрій і Калій – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.2. Натрій і Калій Натрій – 11-й елемент періодичної таблиці, заряд ядра – +11. Хімічний символ – Na. Природний Натрій складається з одного стабільного ізотопу – 23Na; відомо також 6 […]...
- Калійні добрива – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.4. Калійні добрива Грунт – це верхній природний шар земної кори, основною характеристикою якого є родючість. Вона визначається багатьма факторами, зокрема вологістю та наявністю біогенних елементів2 – Нітрогену (30-50 мг/кг), […]...
- Загальна характеристика – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.1. Загальна характеристика Лужні металічні елементи – це s-елементи, які розміщуються у головній підгрупі І групи періодичної системи: Літій (Li), Натрій (Na), Калій (К), Рубідій (Rb), Цезій (Cs) та Францій […]...
- Оксиди Сульфуру – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.8. Оксиди Сульфуру Сульфур(ІV) оксид Сульфур утворює два оксиди – сульфур(ІV) оксид і сульфур(VІ) оксид. Найбільше значення серед сполук Сульфуру зі ступенем окиснення +4 має сульфур(ІV) оксид (сульфур діоксид, сірчистий газ) SO2. […]...
- Фосфор(V) оксид – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.10. Фосфор( V ) оксид Фосфор(V) оксид Р2O5 – твердий білий гігроскопічний (здатний вбирати вологу) порошок, сильний водо-поглинальний засіб; також може забирати воду навіть з хімічних сполук. Стійкий оксид, не виявляє окислювальних […]...
- Силіцій(ІV) оксид – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.7. Силіцій(І V ) оксид Це одна з найпоширеніших у природі сполук. Вона є основою піску, утворює мінерал кварц. Буває кристалічний (кварц і його різновиди – агат, яшма, кремінь, гірський кришталь, основа […]...
- ГІДРОКСИД НАТРІЮ – ЛУЖНІ МЕТАЛИ Хімія – універсальний довідник ЛУЖНІ МЕТАЛИ ГІДРОКСИД НАТРІЮ Гідроксид натрію NаОН широко відомий під назвою їдкий натр. Цю назву (історично вона була першою) він отримав завдяки високій хімічній активності стосовно тваринних тканин – “їдкості” (як і гідроксиди всіх інших лужних металів). Його технічна назва – каустична сода. Гідроксид натрію – розчинна у воді основа, тобто […]...
- Магній і Кальцій РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП § 62. Магній і Кальцій Усвідомлення змісту цього параграфа дає змогу: Характеризувати фізичні та хімічні властивості, способи добування, застосування магнію і кальцію; Складати рівняння, схеми електронного балансу відповідних хімічних реакцій. Фізичні властивості. Магній і Кальцій – сріблясто-білі, пластичні метали (мал. 109), порівняно […]...
- Силікатні матеріали – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.9. Силікатні матеріали Скло звичайне (віконне). Для добування беруть вапняк, соду, білий пісок. При сплавлянні відбуваються реакції: Особливі властивості склу надають добавки Так, магній оксид підвищує хімічну стійкість і механічну міцність скла, […]...
- Ортофосфатна кислота – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.11. Ортофосфатна кислота Ортофосфатна кислота Н3РO4 – це біла тверда речовина, температура плавлення – +42 °С, має необмежену розчинність у воді. Це речовина молекулярної будови, неотруйна. Графічна формула: Відомі також метафосфатна НРО3 […]...
- Сульфатна кислота – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.10. Сульфатна кислота Сульфатна кислота H2SO4 – це речовина молекулярної будови. Атом Сульфуру утворює шість ковалентних зв’язків і набуває ступеня окиснення +6: Безводна сульфатна кислота – це важка, оліїста рідина без кольору […]...
- Алюміній гідроксид – Алюміній ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.4. Алюміній 8.4.2. Алюміній гідроксид Алюміній гідроксид – це біла тверда речовина, яка не розчиняється у воді. Це амфотерна основа. Лише свіжоосаджений алюміній гідроксид розчиняється в лугах та кислотах: А в розчині утворюються комплексні солі: При […]...
- Фізичні властивості металів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.2. Фізичні властивості металів Особливості металічного зв’язку і кристалічних граток зумовлюють загальні фізичні властивості різних металів. 1. Агрегатний стан металів твердий (крім ртуті й, умовно, францію1). Температура плавлення […]...
- Нітратні добрива – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.8. Нітратні добрива1 NaNO3 – натрієва (чилійська) селітра, KNO3 – калієва (індійська) селітра, Ca(NO3)2 – кальцієва (норвезька) селітра. Для добування кальцієвої селітри використовують реакції кальцій оксиду або кальцій гідроксиду з нітратною кислотою: […]...
- ЛУЖНІ, ЛУЖНОЗЕМЕЛЬНІ ЕЛЕМЕНТИ Й МАГНІЙ. ФІЗИЧНІ Й ХІМІЧНІ ВЛАСТИВОСТІ ПРОСТИХ РЕЧОВИН, ОСНОВНИЙ ХАРАКТЕР ЇХ ОКСИДІВ І ГІДРОКСИДІВ, БІОЛОГІЧНА РОЛЬ ЕЛЕМЕНТІВ ТЕМА 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 5. ЛУЖНІ, ЛУЖНОЗЕМЕЛЬНІ ЕЛЕМЕНТИ Й МАГНІЙ. ФІЗИЧНІ Й ХІМІЧНІ ВЛАСТИВОСТІ ПРОСТИХ РЕЧОВИН, ОСНОВНИЙ ХАРАКТЕР ЇХ ОКСИДІВ І ГІДРОКСИДІВ, БІОЛОГІЧНА РОЛЬ ЕЛЕМЕНТІВ Цілі: вивчити положення в ПС, будову атомів лужних, лужноземельних елементів і Магнію, біологічну роль цих елементів, фізичні й хімічні властивості простих речовин, утворених цими елементами; навчитися […]...
- Оксиди Карбону – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.3. Оксиди Карбону Карбон утворює два оксиди – карбон(ІІ) оксид СО та карбон(ІV) оксид СO2 зі ступенями окиснення Карбону відповідно +2 та +4. Карбон(ІІ) оксид, карбон монооксид Атом Карбону в цьому оксиді […]...
- Кисень – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.3. Кисень Фізичні властивості кисню Кисень О2 – це газ без кольору, смаку і запаху, погано розчиняється у воді, зріджується за температури -183 °С (утворюється блакитна рідина), а за температури -219 °С […]...
- Загальні способи добування металів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.5. Загальні способи добування металів У вигляді самородних металів трапляється незначна кількість малоактивних металів: золото, платина, срібло. Більшість металічних елементів трапляється в природі у вигляді сполук – оксидів, […]...
- Карбонатна кислота – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.4. Карбонатна кислота Карбонатна кислота Н2СO3 – слабка двохосновна кислота, існує в дуже розбавлених розчинах. Є слабким електролітом. Дисоціює двоступенево (II ступінь – у незначній мірі): Добування карбонатної кислоти Карбонатну кислоту одержують […]...
- Аміак – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.3. Аміак Аміак (амоніак) – одна з найважливіших сполук Нітрогену. Молекула з чотирма гібридизованими sр3-орбіталями має форму майже правильного тетраедра, валентні кути (H-N-H) – 107,8°. У центрі розташований атом Нітрогену, вершину утворює […]...
- Нітратна кислота – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.6. Нітратна кислота Нітратна кислота HNO3 – одна з найважливіших неорганічних кислот. Зв’язки між атомами в молекулі кислоти полярні ковалентні. Нітроген у нітратній кислоті виявляє свою максимальну валентність – IV, а ступінь […]...