МОДЕЛЬ АТОМА ГІДРОГЕНУ ЗА БОРОМ. ТРУДНОЩІ ТЕОРІЇ БОРА
АТОМНА І ЯДЕРНА ФІЗИКА
Розділ 5 Атомна і ядерна фізика
§ 45. МОДЕЛЬ АТОМА ГІДРОГЕНУ ЗА БОРОМ. ТРУДНОЩІ ТЕОРІЇ БОРА
Використовуючи закони механіки І. Ньютона і правило квантування, яке визначає можливі стаціонарні стани, Н. Бор зумів розрахувати допустимі радіуси орбіт електрона і енергії стаціонарних станів, які мають свій порядковий номер 1, 2, 3… . Мінімальний радіус орбіти визначає розміри атома. На мал. 190, а, б значення енергій стаціонарних станів (електрон-вольт) відкладено на вертикальних осях, у вигляді горизонтальних прямих
Другий постулат Бора дає можливість розрахувати за відомими значеннями енергій стаціонарних станів частоти випромінювання атома Гідрогену. Теорія Бора узгоджує значення цих частот з експериментом. Усі частоти випромінювання атома Гідрогену приводять до ряду серій, кожна з яких утворюється під час переходу атома в один з енергетичних станів з усіх верхніх енергетичних станів (станів з більшою енергією).
Переходи до першого збудженого стану (на другий енергетичний рівень) з верхніх рівнів утворюють серію Бальмера. На мал. 190, а ці переходи зображено стрілками.
Червона,
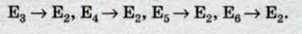

Мал. 190

Мал. 191
Цю серію названо ім’ям І. Бальмера, який ще в 1885 р. на основі експерименту встановив, що частоти чотирьох ліній у видимій частині спектра Гідрогену можуть бути розраховані за такою формулою:
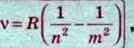
Де R – деяка стала величина, яку називають сталою Рідберга; n – 1, 2, 3, 4, 5,…; m ≥ n + 1.
Ця формула отримала назву – формула Бальмера.
Поглинання світла – процес, протилежний випромінюванню. Атом, коли поглинає світло, переходить з нижчих енергетичних станів на вищі. При цьому він поглинає ті самі частоти, які випромінює під час переходу з вищих енергетичних рівнів на нижчі. На мал. 190, б стрілками показано переходи атома з одних станів на інші з поглинанням світла.
На основі двох постулатів і правила квантування Бор визначив радіус атома Гідрогену і енергії стаціонарних станів атома. Це дало можливість обчислити частоти електромагнітних хвиль, що їх випромінює і поглинає атом.
Найбільший успіх теорія Бора, як уже зазначалося, мала при застосуванні до атома Гідрогену, для якого виявилося можливим побудувати кількісну теорію спектра. Проте побудувати кількісну теорію вже для наступного за Гідрогеном атома Гелію за допомогою постулатів Бора не вдалося. Щодо Гелію і складніших атомів теорія Бора давала змогу робити лише якісні висновки.
Справа в тому, що теорія Бора половинчаста, внутрішньо суперечлива. З одного боку, для побудови теорії атома Гідрогену використовують звичайні закони механіки Ньютона і давно відомий закон Кулона, а з другого – вводяться квантові постулати, зовсім не зв’язані з механікою Ньютона та електродинамікою Максвелла. Введення у фізику квантових уявлень вимагало радикальної перебудови механіки і електродинаміки, що й відбулося на початку другої чверті XX ст., коли було створено нові фізичні теорії: квантову механіку і квантову електродинаміку.
Постулати Бора виявилися цілком правильними. Проте вони вже виступали не як постулати, а тільки як наслідки основних принципів цих теорій. Правило ж квантування Бора виявилося наближеним висновком, який не завжди є застосовним.
Уявлення про певні орбіти, по яких рухається електрон в атомі Бора, дуже умовне. Насправді ж рух електрона в атомі має мало спільного з рухом планет по орбітах. Якби атом Гідрогену в найнижчому енергетичному стані можна було сфотографувати з великою витримкою, то ми побачили б хмарку неоднакової освітленості. Більшу частину часу електрон перебуває на певній відстані від ядра. Цю відстань грубо можна вважати радіусом орбіти. Фотографія атома була б зовсім не схожою на звичний малюнок Сонячної системи, а швидше нагадувала б розпливчасту пляму, нібито фотографували метелика, який безладно пурхає біля ліхтаря.
Тепер, спираючись на квантову механіку, можна дати відповідь на будь – яке запитання, що стосується будови і властивостей електронних оболонок атомів. Але кількісна теорія дуже складна і ми не будемо її торкатися. Якісну характеристику електронних орбіт атомів наведено в курсі хімії.