Головна ⇒ 📌Довідник з хімії ⇒ МОДЕЛЬ ГІБРИДИЗАЦІЇ ВАЛЕНТНИХ ОРБІТАЛЕЙ ЦЕНТРАЛЬНОГО АТОМА – ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ
МОДЕЛЬ ГІБРИДИЗАЦІЇ ВАЛЕНТНИХ ОРБІТАЛЕЙ ЦЕНТРАЛЬНОГО АТОМА – ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ
Хімія – універсальний довідник
БУДОВА РЕЧОВИНИ
ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ
МОДЕЛЬ ГІБРИДИЗАЦІЇ ВАЛЕНТНИХ ОРБІТАЛЕЙ ЦЕНТРАЛЬНОГО АТОМА
Характер гібридизації валентних орбіталей центрального атома і їхнє просторове розташування визначають просторову конфігурацію молекул і комплексних іонів (рис. 11).
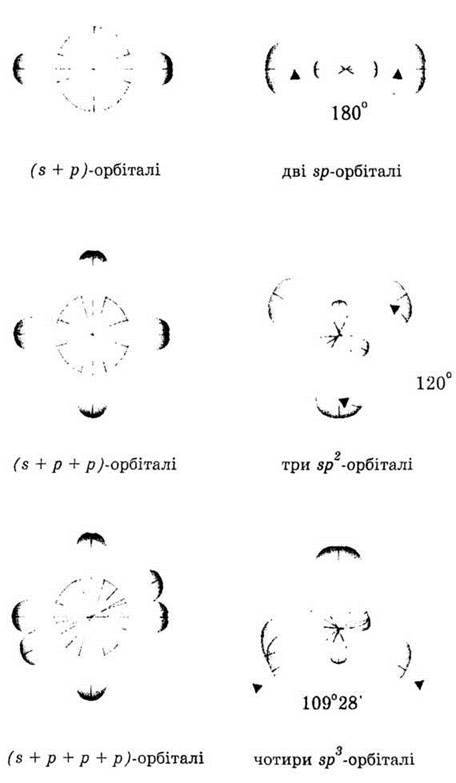
Рис. 11. Гібридизація s – і р-валентних орбіталей.
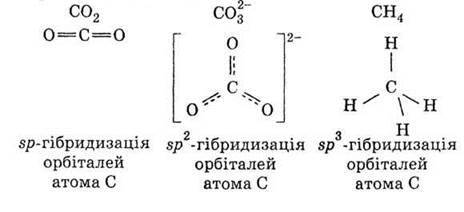
Відповідно до моделі гібридизації орбіталей центрального атома молекула СO2 має лінійну форму, іон СО32- – трикутну, молекула метану СН4 – тетраедричну:
Related posts:
- МОДЕЛЬ ВІДШТОВХУВАННЯ ВАЛЕНТНИХ ЕЛЕКТРОННИХ ПАР ЦЕНТРАЛЬНОГО АТОМА – ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ МОДЕЛЬ ВІДШТОВХУВАННЯ ВАЛЕНТНИХ ЕЛЕКТРОННИХ ПАР ЦЕНТРАЛЬНОГО АТОМА Просторова конфігурація молекули визначається відштовхуванням електронних пар центрального атома: Просторове розташування чотирьох електронних пар умовно відповідає знаходженню їх у вершинах тетраедра (рис.9). Рис. 9. Міжелектронне відштовхування і структура молекул СН4, NН3, Н20. Тетраедричну конфігурацію має також іон амонію NH4+: […]...
- КОМПЛЕКСОУТВОРЕННЯ – ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ КОМПЛЕКСОУТВОРЕННЯ Комплексні іони складаються з центрального іона, зв’язаного зі здатними до самостійного існування молекулами або іонами: Координаційні сполуки: Комплексний іон 2+ має тетраедричну форму, а комплексний іон 4 – октаедричну (рис. 12). Рис. 12. Тетраедрична форма комплексного іона 2+ (а) і октаедрична форма комплексного іона 4- […]...
- Класифікація вуглеводнів. Утворення ковалентних карбон-карбонових зв’язків у органічних сполуках. Види гібридизації електронних орбіталей атома Карбону І СЕМЕСТР Тема 2. ВУГЛЕВОДНІ Урок 6 Тема уроку. Класифікація вуглеводнів. Утворення ковалентних карбон-карбонових зв’язків у органічних сполуках. Види гібридизації електронних орбіталей атома Карбону Цілі уроку: формувати в учнів знання про походження ковалентного карбон-карбонового зв’язку в органічних сполуках та його значення в органічній хімії; ознайомити учнів з поняттям “гібридизація електронних орбіталей” в атомі Карбону, видами […]...
- Гібридизація орбіталей – Ковалентний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.3. Ковалентний зв’язок Гібридизація орбіталей Виходячи з конфігурації електронів, атом Карбону мав би бути двовалентним, утворюючи зв’язки в результаті перекривання двох напівзайнятих 2р-орбіталей з орбіталями інших атомів. Проте це не так: – Карбон у своїх сполуках найчастіше є чотиривалентним. – У молекулі метану є чотири ідентичні зв’язки, які […]...
- МОЛЕКУЛА МЕТАНУ СН4 І IОНА NH4+ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНИЙ ЗВ’ЯЗОК МОЛЕКУЛА МЕТАНУ СН4 І IОНА NH4+ Молекула метану має тетраедричну форму (рис. 7). Рис. 7. Взаємне розміщення атомів у молекулі метану СН4. Енергетичну діаграму орбіталей тетраедричних молекул і іонів без π-зв’язків наведено на рис.8. Рис. 8. Енергетична діаграма орбіталей тетраедричних молекул без π-зв’язків. Електронна конфігурація молекули СН4 […]...
- Обмеженість моделі атома Бора – Модель атома Бора БУДОВА АТОМА 4. Модель атома Бора Обмеженість моделі атома Бора – Постулати Бора теоретично не можуть бути обгрунтовані. – Модель атома Бора можна лише умовно перенести на системи з декількома електронами, тобто на інші елементи, для яких точні розрахунки і пояснення властивостей неможливі....
- ЕЛЕКТРОННА ОБОЛОНКА АТОМА Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНІ ЕЛЕМЕНТИ. ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА ЕЛЕКТРОННА ОБОЛОНКА АТОМА Теорія будови електронної оболонки атома грунтується на законах квантової (хвильової) механіки. Згідно з законами квантової механіки можна говорити лише про ймовірність перебування електрона в даній точці простору навколо ядра. Модель стану електрона в атомі відповідає уявленню про […]...
- Гібридизація електронних орбіталей ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.4. Гібридизація електронних орбіталей Під час утворення молекул з ковалентним полярним зв’язком у деяких атомів відбувається характерне явище, яке називають гібридизацією електронних орбіталей – перетворення електронних орбіталей різного виду (s, р)1 на однакові за формою та енергією гібридні орбіталі. Sp3-гібридизація […]...
- ПЛАНЕТАРНА МОДЕЛЬ АТОМА РЕЗЕРФОРДА Фізика підготовка до ЗНО комплексне видання КВАНТОВА ФІЗИКА. ЕЛЕМЕНТИ ТЕОРІЇ ВІДНОСНОСТІ 3. АТОМ ТА АТОМНЕ ЯДРО 3.1. ПЛАНЕТАРНА МОДЕЛЬ АТОМА РЕЗЕРФОРДА Резерфорд на підставі спостережень за розсіюванням α-частинок при проходженні їх через золоту фольгу обгрунтував модель атома (рис. З, а, б). Планетарна (ядерна) модель атома Резерфорда Атом складається з ядра, яке займає дуже малий об’єм […]...
- МЕТОД ВАЛЕНТНИХ ЗВ’ЯЗКІВ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНИЙ ЗВ’ЯЗОК МЕТОД ВАЛЕНТНИХ ЗВ’ЯЗКІВ Відповідно до методу валентних зв’язків хімічний зв’язок двоцентровий і двохелектронний:...
- Властивості ковалентного зв’язку ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 3. ХІМІЧНИЙ ЗВ’ЯЗОК § 3.2. Властивості ковалентного зв’язку Характерні властивості ковалентного зв’язку – його довжина, енергія, насичуваність і напрямленість. Довжина зв’язку – це між’ядерна відстань. Хімічний зв’язок тим міцніший, чим менша його довжина. Однак мірою міцності зв’язку є його енергія. Енергія […]...
- Зображення орбіталей БУДОВА АТОМА 6 . Хвильова модель 6.2 . Зображення орбіталей Щоб наочно показати конфігурацію електронів атома, Л. Паулі запропонував зображувати його орбіталі у вигляді електронних комірок. Електрони в них зображають вертикальними стрілками. Для розпізнавання спінового квантового числа стрілки направлені у протилежних напрямах. Запам’ятайте: два електрони з протилежним спіном, які знаходяться на одній і тій самій […]...
- Досягнення моделі Бора – Модель атома Бора БУДОВА АТОМА 4. Модель атома Бора Поштовхом для подальшого розвитку моделі атома Нільсоном Бором став відкритий у 1885 році Дж. Бальмером факт, що довжини хвиль усіх ліній видимого спектра газоподібного водню можна обчислити простою математичною формулою: λ – довжина хвилі лінії спектра; RН – стала Рідберга; N – порядкове число (n > 2). N λ/нм […]...
- Будова речовини. Будова атома. Залежність швидкості руху атомів і молекул від температури тіла. Дифузія. Лабораторна робота № 6 “Дослідження явища дифузії в рідинах і газах” Розділ 2. БУДОВА РЕЧОВИНИ УРОК № 10 ТЕМА. Будова речовини. Будова атома. Залежність швидкості руху атомів і молекул від температури тіла. Дифузія. Лабораторна робота № 6 “Дослідження явища дифузії в рідинах і газах” Мета: сформувати уявлення про атоми та молекули, залежність швидкості їх хаотичного руху від температури, ознайомити з явищем дифузії; розвивати в учнів уміння […]...
- МОДЕЛЬ АТОМА ГІДРОГЕНУ ЗА БОРОМ. ТРУДНОЩІ ТЕОРІЇ БОРА АТОМНА І ЯДЕРНА ФІЗИКА Розділ 5 Атомна і ядерна фізика § 45. МОДЕЛЬ АТОМА ГІДРОГЕНУ ЗА БОРОМ. ТРУДНОЩІ ТЕОРІЇ БОРА Використовуючи закони механіки І. Ньютона і правило квантування, яке визначає можливі стаціонарні стани, Н. Бор зумів розрахувати допустимі радіуси орбіт електрона і енергії стаціонарних станів, які мають свій порядковий номер 1, 2, 3… . Мінімальний […]...
- МАСА АТОМІВ І МОЛЕКУЛ Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 1. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ 1.3. МАСА АТОМІВ І МОЛЕКУЛ Маси атомів і молекул прийнято порівнювати з 1/12 маси атома ізотопу Карбону 126С. Відносною молекулярною масою Мr називають відношення маси молекули mo до 1/12 маси атома Карбону m0с (атомної одиниці маси, а. о. м.): Де Мr […]...
- Поняття про радіус атома – Періодичний закон та теорія будови атома Хімія Загальна хімія Періодичний закон та теорія будови атома Поняття про радіус атома Атоми не мають чітко визначених меж, що зумовлено хвильовою природою електронів. У розрахунках користуються ефективними Й уявними радіусамИ, тобто радіусами шароподібних атомів, зближених між собою під час утворення кристала. Їх розраховують за допомогою рентгенометричних даних. Чим більший атомний радіус, тим слабкіше утримуються […]...
- Ядерна модель (модель Резерфорда) БУДОВА АТОМА 3. Ядерна модель (модель Резерфорда) При опроміненні найтоншої золотої фольги α-частинками більшість частинок проходить через фольгу по прямій лінії, деякі з них відхиляються на різні кути, а приблизно 1 частинка зі 100 000 відбивається назад. Результати цього експерименту з розсіювання α-частинок, проведеного в 1911 році, неможливо пояснити моделлю Томсона. Ядерна модель Резерфорда заперечує […]...
- Метан. Молекулярна, електронна і структурна формули метану, поширення в природі Тема 3 НАЙВАЖЛИВІШІ ОРГАНІЧНІ СПОЛУКИ Урок 33 Тема уроку. Метан. Молекулярна, електронна і структурна формули метану, поширення в природі Цілі уроку: формувати знання учнів про молекулярну, електронну й структурну формули метану; ознайомити учнів з поняттям “гібридизація електронних орбіталей” на прикладі sp3-гібридизації електронів у атомі Карбону; поглибити знання про поширення органічних сполук у природі на прикладі […]...
- ЕЛЕКТРОННА БУДОВА АТОМА Хімія – універсальний довідник БУДОВА АТОМА ЕЛЕКТРОННА БУДОВА АТОМА Хімічні властивості визначаються електронною будовою атома. Описати електронну будова атома – це означає, насамперед, зазначити розподіл електронної густини біля ядра, тобто визначити ділянку простору, де можуть знаходитися електрони даного атома. Але для повного опису електронної будови атома цього недостатньо. Найважливішою характеристикою руху електрона на даній орбіталі […]...
- Елементи головних і побічних підгруп – Періодична система елементів і хвильова модель БУДОВА АТОМА 6 . Хвильова модель 6.3 . Періодична система елементів І хвильова модель Порядок розташування елементів у періодичній системі можна пояснити на основі принципу заповнення орбіталей. Електронну конфігурацію будь-якого елемента можна вивести, виходячи із трьох принципів, що знаходяться в тісному зв’язку з урахуванням квантових чисел. – Рівні з меншою енергією заповнюються в першу чергу […]...
- МОЛЕКУЛИ АЗОТУ N2, КИСНЮ O2 І ФТОРУ F2 Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНИЙ ЗВ’ЯЗОК МОЛЕКУЛИ АЗОТУ N2, КИСНЮ O2 І ФТОРУ F2 Енергетична діаграма орбіталей двохатомних молекул елементів другого періоду наведена на рис. 6. Рис. 6. Енергетична діаграма орбіталей двохатомних молекул s – і р-елементів. Користуючись рис. 6, можна скласти електронні конфігурації двохатомних s – і р-елементів. Електронна конфігурація Структурна Молекули […]...
- Послідовність заповнення орбіталей електронами – Електрон. Електронні шари ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 2. Будова атома 2.4. Електрон. Електронні шари Сучасна теорія електронної будови атома грунтується, на важливому розділі фізики – квантовій механіці, який описує властивості мікроскопічних об’єктів. Згідно з уявленнями квантової механіки, електрон як мікрочастинка має двоїсту природу: виявляє властивості частинки і хвилі. Розглядається не […]...
- Досягнення моделі будови електронних оболонок атомів – Модель будови електронних оболонок атомів БУДОВА АТОМА 5 . Модель будови електронних оболонок атомів Основні припущення теорії Бора можна перенести в якісному відношенні на прості системи з декількома валентними електронами, наприклад, такі як атоми лужних металів. – Електрони розташовуються навколо ядра на оболонках (шарах). – Усього в атомах розрізняють до семи оболонок (шарів). – Кожна оболонка є певним рівнем енергії […]...
- Збуджений стан атома – Електрон. Електронні шари ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 2. Будова атома 2.4. Електрон. Електронні шари 2.4.2. Збуджений стан атома При збудженні атомів електрони набувають більшої енергії, відбувається перехід електронів з нижчих енергетичних підрівнів на вищі. Так, в атома Сульфуру є вільні d-орбіталі, тому можливий перехід одного зі спарених електронів з 3p-орбіталі […]...
- ПОЛОЖЕННЯ ЕЛЕМЕНТІВ У ПЕРІОДИЧНІЙ СИСТЕМІ Д. І. МЕНДЕЛЄЄВА І СТРУКТУРА УТВОРЕННЯ НИМИ ПРОСТИХ РЕЧОВИН – КРИСТАЛИ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ КРИСТАЛИ ПОЛОЖЕННЯ ЕЛЕМЕНТІВ У ПЕРІОДИЧНІЙ СИСТЕМІ Д. І. МЕНДЕЛЄЄВА І СТРУКТУРА УТВОРЕННЯ НИМИ ПРОСТИХ РЕЧОВИН Будова простих речовин визначається числом валентних електронів (рис. 24). Рис. 24. Моделі будови простих речовин елементів третього періоду: Аргон Аr – молекула одноатомна; Хлор Сl2 – молекула двохатомна; Сірка S8 – молекула восьмиатомна; Сірка […]...
- Алкени. Гомологічний ряд етену, загальна формула алкенів. Структурна й просторова ізомерія алкенів, номенклатура І СЕМЕСТР Тема 2. ВУГЛЕВОДНІ Урок 12 Тема уроку. Алкени. Гомологічний ряд етену, загальна формула алкенів. Структурна й просторова ізомерія алкенів, номенклатура Цілі уроку: формувати знання учнів про гомологічний ряд алкенів на прикладі етилену; ознайомити учнів із природою кратного зв’язку, новими видами ізомерії – ізомерією положення кратного зв’язку, міжкласовою ізомерією; розвивати на прикладі алкенів навички […]...
- РОЗМІРИ МОЛЕКУЛ І АТОМІВ Розділ 2. БУДОВА РЕЧОВИНИ §8 . АТОМИ ТА МОЛЕКУЛИ 3. РОЗМІРИ МОЛЕКУЛ І АТОМІВ ПРОВЕДЕМО ДОСЛІД Капнемо на поверхню спокійної води крапельку олії (краще взяти оливкову олію). Олія розтечеться по поверхні води дуже тонким шаром. Однак товщина олійної плівки не може бути меншою від розміру молекули олії, що й визначає максимальну площу плівки (рис. 8.7). […]...
- Теорія будови атома – Періодичний закон та теорія будови атома Хімія Загальна хімія Періодичний закон та теорія будови атома Теорія будови атома Атом – це електронейтральна частинка, що складається з позитивно зарядженого ядра і негативно заряджених електронів. Будова атомних ядер Ядра атомів Складаються з елементарних частинок двох видів: протонів (p) і нейтронів (n). Сума протонів і нейтронів у ядрі одного атома називається нуклонним числом: , […]...
- Ковалентний полярний і неполярний зв’язок, іонний зв’язок. Електронні формули молекул речовин Тема 4 ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ УРОК 58 Тема. Ковалентний полярний і неполярний зв’язок, іонний зв’язок. Електронні формули молекул речовин Цілі уроку: закріпити знання про види хімічного зв’язку; розвивати навички написання електронних формул речовин, уміння визначати вид хімічних зв’язків у молекулах за будовою атомів, що утворюють цю молекулу. Тип уроку: засвоєння знань, умінь і […]...