Головна ⇒ 📌Довідник з хімії ⇒ МОЛЕКУЛА МЕТАНУ СН4 І IОНА NH4+
МОЛЕКУЛА МЕТАНУ СН4 І IОНА NH4+
Хімія – універсальний довідник
БУДОВА РЕЧОВИНИ
ХІМІЧНИЙ ЗВ’ЯЗОК
МОЛЕКУЛА МЕТАНУ СН4 І IОНА NH4+
Молекула метану має тетраедричну форму (рис. 7).
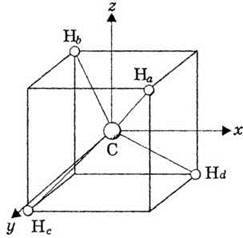
Рис. 7. Взаємне розміщення атомів у молекулі метану СН4.
Енергетичну діаграму орбіталей тетраедричних молекул і іонів без π-зв’язків наведено на рис.8.
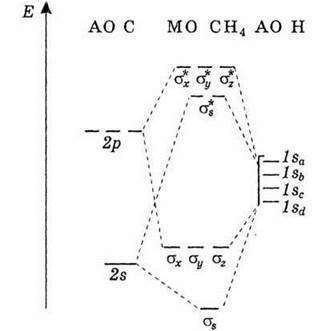
Рис. 8. Енергетична діаграма орбіталей тетраедричних молекул без π-зв’язків.
Електронна конфігурація молекули СН4 і іона NН4+:
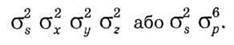
Related posts:
- МОЛЕКУЛИ АЗОТУ N2, КИСНЮ O2 І ФТОРУ F2 Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНИЙ ЗВ’ЯЗОК МОЛЕКУЛИ АЗОТУ N2, КИСНЮ O2 І ФТОРУ F2 Енергетична діаграма орбіталей двохатомних молекул елементів другого періоду наведена на рис. 6. Рис. 6. Енергетична діаграма орбіталей двохатомних молекул s – і р-елементів. Користуючись рис. 6, можна скласти електронні конфігурації двохатомних s – і р-елементів. Електронна конфігурація Структурна Молекули […]...
- МОЛЕКУЛЯРНІ ОРБІТАЛІ. МОЛЕКУЛА Н2 Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНИЙ ЗВ’ЯЗОК МОЛЕКУЛЯРНІ ОРБІТАЛІ. МОЛЕКУЛА Н2 Для опису розподілу електронної густини в молекулі використовують уявлення про молекулярну орбіталь. Молекулярна орбіталь – ділянка простору в молекулі, в якій можливе перебування електрона. Знаходження електрона між атомними ядрами молекули описує зв’язуюча молекулярна орбіталь. Знаходження електрона в молекулі за атомними ядрами описує антизв’язуюча […]...
- МОДЕЛЬ ГІБРИДИЗАЦІЇ ВАЛЕНТНИХ ОРБІТАЛЕЙ ЦЕНТРАЛЬНОГО АТОМА – ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ МОДЕЛЬ ГІБРИДИЗАЦІЇ ВАЛЕНТНИХ ОРБІТАЛЕЙ ЦЕНТРАЛЬНОГО АТОМА Характер гібридизації валентних орбіталей центрального атома і їхнє просторове розташування визначають просторову конфігурацію молекул і комплексних іонів (рис. 11). Рис. 11. Гібридизація s – і р-валентних орбіталей. Відповідно до моделі гібридизації орбіталей центрального атома молекула СO2 має лінійну форму, іон […]...
- Метан. Молекулярна, електронна і структурна формули метану, поширення в природі Тема 3 НАЙВАЖЛИВІШІ ОРГАНІЧНІ СПОЛУКИ Урок 33 Тема уроку. Метан. Молекулярна, електронна і структурна формули метану, поширення в природі Цілі уроку: формувати знання учнів про молекулярну, електронну й структурну формули метану; ознайомити учнів з поняттям “гібридизація електронних орбіталей” на прикладі sp3-гібридизації електронів у атомі Карбону; поглибити знання про поширення органічних сполук у природі на прикладі […]...
- Гомологи метану. Молекулярні та структурні формули. Значення моделювання в хімії. Фізичні властивості гомологів метану Тема 3 НАЙВАЖЛИВІШІ ОРГАНІЧНІ СПОЛУКИ Урок 34 Тема уроку. Гомологи метану. Молекулярні та структурні формули. Значення моделювання в хімії. Фізичні властивості гомологів метану Цілі уроку: формувати знання учнів про гомологію, гомологічні ряди на прикладі алканів; ознайомити учнів з номенклатурою алканів за міжнародною номенклатурою IUPAC; розвивати навички й уміння складати структурні формули й назви органічних сполук […]...
- КОМПЛЕКСОУТВОРЕННЯ – ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ КОМПЛЕКСОУТВОРЕННЯ Комплексні іони складаються з центрального іона, зв’язаного зі здатними до самостійного існування молекулами або іонами: Координаційні сполуки: Комплексний іон 2+ має тетраедричну форму, а комплексний іон 4 – октаедричну (рис. 12). Рис. 12. Тетраедрична форма комплексного іона 2+ (а) і октаедрична форма комплексного іона 4- […]...
- Хімічні властивості метану та його гомологів ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина III. ОРГАНІЧНА ХІМІЯ Розділ 16. ВУГЛЕВОДНІ § 16.3. Хімічні властивості метану та його гомологів Члени гомологічного ряду алканів мають спільні хімічні властивості. Це малоактивні речовини. Усі реакції за їх участю можна розділити на два типи: реакції з розривом зв’язків С-Н (наприклад, реакції заміщення) та реакції […]...
- МОДЕЛЬ ВІДШТОВХУВАННЯ ВАЛЕНТНИХ ЕЛЕКТРОННИХ ПАР ЦЕНТРАЛЬНОГО АТОМА – ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ МОДЕЛЬ ВІДШТОВХУВАННЯ ВАЛЕНТНИХ ЕЛЕКТРОННИХ ПАР ЦЕНТРАЛЬНОГО АТОМА Просторова конфігурація молекули визначається відштовхуванням електронних пар центрального атома: Просторове розташування чотирьох електронних пар умовно відповідає знаходженню їх у вершинах тетраедра (рис.9). Рис. 9. Міжелектронне відштовхування і структура молекул СН4, NН3, Н20. Тетраедричну конфігурацію має також іон амонію NH4+: […]...
- ЕЛЕКТРОННА ОБОЛОНКА АТОМА Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНІ ЕЛЕМЕНТИ. ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА ЕЛЕКТРОННА ОБОЛОНКА АТОМА Теорія будови електронної оболонки атома грунтується на законах квантової (хвильової) механіки. Згідно з законами квантової механіки можна говорити лише про ймовірність перебування електрона в даній точці простору навколо ядра. Модель стану електрона в атомі відповідає уявленню про […]...
- Основні поняття атомно-молекулярного вчення. Атом. Молекула. Хімічний елемент Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ ЗАКОНИ Й ПОНЯТТЯ ХІМІЇ Основні поняття атомно-молекулярного вчення. Атом. Молекула. Хімічний елемент Основними поняттями атомно-молекулярного вчення є “молекула”, “атом”, “хімічний елемент”, “прості й складні речовини”. Молекула – це найменша частинка речовини, що здатна існувати самостійно, зберігаючи основні хімічні властивості цієї речовини. Існування […]...
- Механізм дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.6. Механізм дисоціації Суттєвим є питання про механізм електролітичної дисоціації. І дійсно, чому електроліти дисоціюють на іони? Вчення про хімічний зв’язок атомів допомагає відповісти на це запитання. Найлегше дисоціюють речовини з іонним зв’язком. Як відомо, […]...
- Основні положення атомно-молекулярного вчення Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ ЗАКОНИ Й ПОНЯТТЯ ХІМІЇ Основні положення атомно-молекулярного вчення 1. Речовини мають дискретну будову. Вони складаються з частинок (структурних елементів речовини) – молекул, атомів або іонів. 2. Частинки речовини (молекули, атоми або іони) перебувають у безперервному русі. 3. Між складовими частинками речовини діють […]...
- ЕНЕРГІЯ АКТИВАЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ЕНЕРГІЯ АКТИВАЦІЇ Енергія активації Еа – надлишкова енергія, яку повинні мати молекули, щоб у результаті їхнього зіткнення відбулася хімічна реакція. Хімічна реакція Здійснюється через утворення активованого комплексу А2 … В2, в якому відбувається перегрупування атомів (рис. 44): Рис. 44. Енергетична схема проходження […]...
- Електронна природа хімічних зв’язків у молекулах органічних сполук ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ III. ОРГАНІЧНА ХІМІЯ 10. Теоретичні основи органічної хімії 10.4. Електронна природа хімічних зв’язків у молекулах органічних сполук Розгляньмо електронну будову атома Карбону. Як випливає з електронно-графічної формули, в основному стані атом Карбону виявляє валентність II, а в збудженому – IV. В органічних сполуках атом Карбону перебуває […]...
- Умови виникнення хімічного зв’язку Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ Умови виникнення хімічного зв’язку Хімічний зв’язок – це взаємодія атомів, здійснювана шляхом обміну електронами або їхнім переходом від одного атома до іншого. Не всі атоми можуть взаємодіяти між собою. Буває так, що при зближенні атомів та перекриванні їхніх […]...
- Гібридизація електронних орбіталей ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.4. Гібридизація електронних орбіталей Під час утворення молекул з ковалентним полярним зв’язком у деяких атомів відбувається характерне явище, яке називають гібридизацією електронних орбіталей – перетворення електронних орбіталей різного виду (s, р)1 на однакові за формою та енергією гібридні орбіталі. Sp3-гібридизація […]...
- Властивості ковалентного зв’язку ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 3. ХІМІЧНИЙ ЗВ’ЯЗОК § 3.2. Властивості ковалентного зв’язку Характерні властивості ковалентного зв’язку – його довжина, енергія, насичуваність і напрямленість. Довжина зв’язку – це між’ядерна відстань. Хімічний зв’язок тим міцніший, чим менша його довжина. Однак мірою міцності зв’язку є його енергія. Енергія […]...
- Гібридизація орбіталей – Ковалентний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.3. Ковалентний зв’язок Гібридизація орбіталей Виходячи з конфігурації електронів, атом Карбону мав би бути двовалентним, утворюючи зв’язки в результаті перекривання двох напівзайнятих 2р-орбіталей з орбіталями інших атомів. Проте це не так: – Карбон у своїх сполуках найчастіше є чотиривалентним. – У молекулі метану є чотири ідентичні зв’язки, які […]...
- БУДОВА ВУГЛЕВОДНІВ. 1. ГОМОЛОГИ – ОРГАНІЧНІ СПОЛУКИ Хімія – універсальний довідник ОРГАНІЧНІ СПОЛУКИ БУДОВА ВУГЛЕВОДНІВ. 1. ГОМОЛОГИ Найпростіша органічна сполука – вуглеводень метан СН4. У молекулі метану навколо атома Карбону симетрично розташовуються чотири атоми Гідрогену. Її просторову будову можна уявити тетраедром з атомом Карбону в центрі й атомами Гідрогену у вершинах. При заміщенні атомів Гідрогену на інші атоми (наприклад, Хлору в тетрахлорметані) […]...
- Найважливіші характеристики ковалентного зв’язку ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.6. Найважливіші характеристики ковалентного зв’язку Характерні властивості ковалентного зв’язку – кратність, довжина, енергія, насиченість, спрямованість, полярність – визначають фізичні та хімічні властивості сполук. Кратність зв’язку визначається кількістю спільних електронних пар, які зв’язують атоми. Відповідно ковалентний зв’язок буває простим (одинарним), подвійним […]...
- АЗОТ ЯК ПРОСТА РЕЧОВИНА – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ АЗОТ ЯК ПРОСТА РЕЧОВИНА Молекула N2 – найміцніша з усіх молекул відомих простих речовин, це – взагалі одна з найміцніших молекул (енергія хімічного зв’язку вища тільки в молекулі СО), тому у природі Нітроген знаходиться, в основному, у вигляді простої речовини N2 – однієї з основних складових частин повітря, […]...
- Вправа 89-94 № 89. Коефіцієнт – цифра перед хімічною формулою, позначає кількість молекул речовини. 2O2 – дві молекули кисню; 3Сu – три атоми міді. Індекс – маленька цифра, записана нижче і справа від символу елементу. Показує кількість атомів елементів, які входять до складу молекули. Н2O – молекула води складається з 2 атомів Гідрогену і одного атому Оксигену. […]...
- Хімічна структура та хімічна будова – ЗАГАЛЬНА ХАРАКТЕРИСТИКА ОРГАНІЧНИХ СПОЛУК Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ ЗАГАЛЬНА ХАРАКТЕРИСТИКА ОРГАНІЧНИХ СПОЛУК Хімічна структура та хімічна будова Перший постулат Бутлерова. У молекулах речовин існує певний порядок зв’язування атомів, що називається хімічною структурою, або будовою речовини. Кожній індивідуальній речовині відповідає одна-єдина певна хімічна структура. В органічній хімії Карбон завжди перебуває […]...
- Будова молекули води. Водневий зв’язок між молекулами води ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.4. Будова молекули води. Водневий зв’язок між молекулами води У молекулі води є два ковалентні полярні зв’язки між атомом Оксигену і двома атомами Гідрогену. Через велику різницю електронегативності Оксигену (3,5) і Гідрогену (2,2) електронні хмари зміщені в бік Оксигену, […]...
- Гідратація іонів – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.7. Гідратація іонів Відомий російський хімік І. О. Каблуков довів, що електролітичну дисоціацію не можна пояснити без хімічної теорії розчинів Д. І. Менделєєва. Як відомо, Д. І. Менделєєв експериментально обгрунтував утворення хімічних сполук під час […]...
- Атомно-молекулярне вчення в хімії ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.1. Атомно-молекулярне вчення в хімії Атомно-молекулярне вчення розвинув і вперше застосував у хімії великий російський учений М. В. Ломоносов. Основні положення цього вчення викладено у праці “Елементи математичної хімії” (1741) та в інших. Суть […]...
- СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ Якщо реакція речовини з водою, яка призводить до утворення іонів, не проходить до кінця і у розчині залишаються молекули вихідної речовини, тобто процес електролітичної дисоціації оборотний, то така речовина належить до слабких електролітів. Крім описаних у попередньому параграфі води й аміаку, до слабких електролітів належать майже […]...
- ФІЗИЧНІ ВЛАСТИВОСТІ ВОДНЮ – ВОДЕНЬ Хімія – універсальний довідник ВОДЕНЬ ФІЗИЧНІ ВЛАСТИВОСТІ ВОДНЮ Молекула водню двохатомна – Н2. За звичайних умов – це газ без кольору, запаху і смаку. Водень – найлегший газ, його густина у багато разів менша за густину повітря. Очевидно, що чим менша маса молекул, тим вища їхня швидкість за однакової температури. Як найлегші, молекули водню рухаються […]...
- ЕЛЕКТРОЛІЗ ВОДИ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ЕЛЕКТРОЛІЗ ВОДИ Електроліз води – окисно-відновний процес розкладу води з утворенням водню і кисню. На катоді відбувається відновлення води з утворенням іонів ОН – і молекул Н2: На аноді здійснюється окиснення води з утворенням молекул О2 і іонів Н+: Дія електричного струму призводить […]...
- КРИСТАЛІЧНИЙ СТАН РЕЧОВИНИ – КРИСТАЛИ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ КРИСТАЛИ КРИСТАЛІЧНИЙ СТАН РЕЧОВИНИ Кристали – тверді тіла, в яких атоми, іони або молекули утворюють впорядковану періодичну структуру. Кристалічні гратки – просторове періодичне розташування атомів, молекул або іонів у кристалі. Кристалічний стан характеризується дальнім порядком розташування частинок, що утворюють речовину. Рідина характеризується ближнім порядком, а газовий стан характеризується повного […]...
МЕРВА »