Нітратна кислота – Елементи VA групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
9.4. Елементи VA групи
9.4.6. Нітратна кислота
Нітратна кислота HNO3 – одна з найважливіших неорганічних кислот. Зв’язки між атомами в молекулі кислоти полярні ковалентні. Нітроген у нітратній кислоті виявляє свою максимальну валентність – IV, а ступінь окиснення Нітрогену найвищий для цього елемента і становить +5. Нітратна кислота має молекулярну будову. Структурна формула:
У молекулі нітратної кислоти атом Нітрогену утворює чотири ковалентні зв’язки: три з них утворюються за обмінним механізмом, а ще один – за донорно-акцепторним. Атом Нітрогену – донор, тому що віддає свою неподілену електронну пару одному з атомів Оксигену, який надає вільну p-орбіталь (акцептор).
Фізичні властивості нітратної кислоти
Хімічно чиста нітратна кислота за стандартних умов – це безбарвна рідина з характерним запахом. Технічна кислота має жовтуватий колір, тому що при її частковому розкладі на світлі утворюється бурий NO2, який розчиняється в кислоті.
Нітратна
Добування нітратної кислоти
У лабораторії кислоту одержують дією на її кристалічні солі концентрованою сульфатною кислотою при нагріванні:
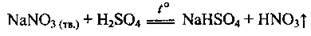
У промисловості нітратну кислоту добувають аміачним способом у три стадії:
1) каталітичне окиснення аміаку з використанням платинового каталізатора:
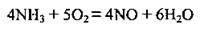
2) окиснення нітроген(ІІ) оксиду киснем повітря до NO2:
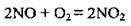
3) поглинання нітроген(ІV) оксиду водою за наявності надлишку кисню:
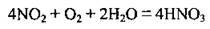
Одержують кислоту з масовою часткою HNO3 40-60 %. Більш концентровану кислоту з масовою часткою кислоти 96-98 % отримують перегонкою суміші H2SO4 і розбавленої HNO3.
Хімічні властивості нітратної кислоти
Нітратна кислота належить до сильних одноосновних кислот. У розбавлених розчинах вона майже повністю дисоціює на йони:
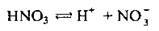
Для неї характерні загальні властивості кислот, за винятком реакцій з металами.
1. Загальні властивості кислот:
А) взаємодіє з амфотерними та основними оксидами:
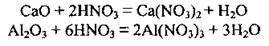
Б) взаємодіє з основами:
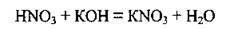
Якщо основа багатокислотна, то можливе утворення основний солей:
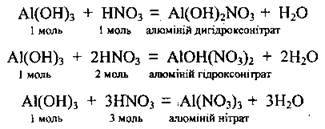
В) взаємодіє із солями слабких кислот:
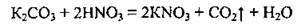
2. Нітратна кислота розкладається на світлі або при нагріванні:
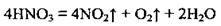
3. Нітратна кислота виявляє сильні окисні властивості. Вони зумовлені найвищим ступенем окиснення Нітрогену – +5. Відновлення кислоти може відбуватись до оксидів (NO2, NO, N2O), до азоту N2 і амоній нітрату NH4NO3.
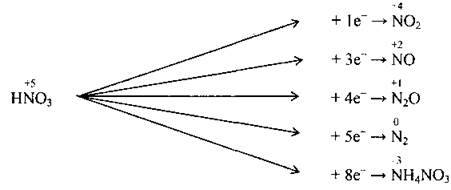
А) взаємодія з металами – нітратна кислота як сильний окисник взаємодіє майже з усіма металами, однак водень при цьому ніколи не виділяється.
Концентрована нітратна кислота за стандартних умов не діє на Fe, Сr, Al, Pt, Au, Іr, Та:
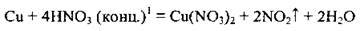
З лужними і лужноземельними металами розбавлена нітратна кислота відновлюється до амоній нітрату NH4NO3, а концентрована – до нітроген(І) оксиду N2O:
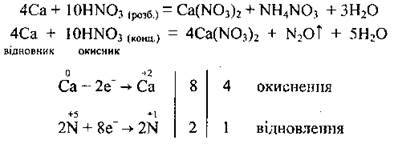
Реагує з алюмінієм під час нагрівання:
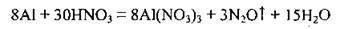
З малоактивними металами (Ag, Cu, Hg) розбавлена нітратна кислота відновлюється до нітроген(ІІ) оксиду NO, а концентрована – до нітроген(ІV) оксиду NO2:
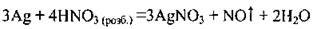
Б) взаємодія з неметалами – нітратна кислота окислює неметали до їхнього найвищого ступеня окиснення. Так, сірку окислює до сульфатної кислоти (ступінь окиснення Сульфуру – +6), фосфор – до ортофосфатної кислоти (ступінь окиснення Фосфору стає +5), вуглець – до карбон(ІV) оксиду (ступінь окиснення Карбону – +4):
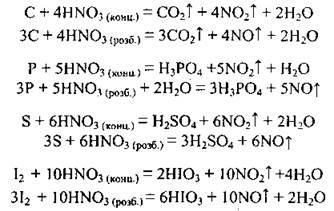
В) взаємодія зі складними неорганічними речовинами, які виявляють відновні властивості:
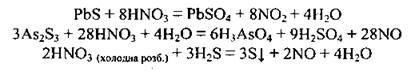
Застосування нітратної кислоти
Нітратну кислоту застосовують у виробництві барвників, лікарських препаратів, вибухових речовин, пластмас, штучних волокон, кіно – і фотоплівки, азотних добрив, як окисник у реактивних двигунах, у металургії для розчинення металів та очищення їхньої поверхні від оксидів.
______________________________________________________________
1 Концентрованою сульфантою кислотою зазвичай називають водний розчин HNO3 з концентрацією 63-65 %.