Обчислення за рівнянням хімічної реакції, якщо один з реагентів узято в надлишку
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ VIIA ГРУПИ
§ 22. Обчислення за рівнянням хімічної реакції, якщо один з реагентів узято в надлишку
Усвідомлення змісту цього параграфа дає змогу: розв’язувати задачі на надлишок.
Розглянемо рівняння реакції водню з хлором:
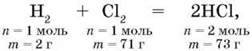
За яким водень масою 2 г реагує з хлором масою 71 г з утворенням хлороводню масою 73 г. А скільки утвориться хлороводню з суміші 2 г водню й 75 г хлору? Так само – 73 г хлороводню, оскільки за рівнянням реакції водень масою
73 г хлороводню. Хлор масою 4 г (75 г – 71 г = 4 г) є надлишком і залишиться в суміші з основним продуктом – хлороводнем. Отже,
Якщо в умові задачі дано кількості двох реагентів, то розрахунки за рівнянням реакції здійснюють за тією речовиною, що прореагує повністю, а не тією, яка є в надлишку.
Нехай змішали 10 г водню й 284 г хлору. Як визначити, яка речовина з двох прореагує повністю, а яка – в надлишку? Пропонуємо два способи: першим доцільно користуватися, якщо коефіцієнти в рівнянні реакції прості й невеликі; другим – якщо співвідношення кількості
І спосіб | ІІ спосіб |
1) Записати співвідношення кількостей речовини реагентів за рівнянням реакції: П(Н2) : n(Cl2) = 1 : 1. (1) 2) Обчислити п(Н2) і n(Cl2) за умовою задачі: П(Н2) = т(Н2) : М(Н2) = = 10 г : 2 г/моль = 5 моль, n(Cl2) = m(Cl2) : M(Cl2) = = 284 г : 71 г/моль = 4 моль. 3) Записати їх співвідношення: п(Н2) : n(Cl2) = 5 : 4 = 1,25 : 1. (2) 4) Порівняти співвідношення (1) і (2) та визначити речовину, яка в надлишку, а яка – прореагує повністю: П(Н2) : n(Cl2) = 1 : 1 (за рівнянням реакції); п(Н2) : n(Cl2) = 1,25 : 1 (за умовою задачі). У надлишку Н2, повністю прореагує Cl2. Висновок: обчислення робимо за хлором | 1) Обчислити п(Н2) і n(Cl2) за умовою задачі: П(Н2) = т(Н2) : М(Н2) = = 10 г : 2 г/моль = 5 моль; n(Cl2) = m(Cl2) : M(Cl2) = = 284 : 71 г/моль = 4 моль. 2) Позначити n моль однієї з вихідних речовин за невідому х: нехай п(Сl2) = х. 3) Обчислити х, склавши пропорцію: 5 : х = 1 : 1, х = 5 моль, тобто для реакції з 5 моль Н2 потрібно 5 моль Cl2. 4) Порівняти n(Cl2), обчислену в п. 3, із n(Cl2), обчисленою в п.1: Н2 – у надлишку, Cl2 прореагує повністю. Висновок: обчислення робимо за хлором |
Задачі, умова яких містить відомості про кількість речовини, масу, об’єм обох реагентів, належать до типу “Задачі на обчислення за рівнянням реакції, якщо один з реагентів узято в надлишку”, або скорочено “Задачі на надлишок”.
Розглянемо приклади таких задач.
Задача 1. Обчисліть масу кальцій хлориду, що можна добути реакцією кальцію масою 40 г із хлором масою 142 г.
При розв’язуванні цієї задачі речовину, яка повністю прореагує, визначаємо за способом 1.
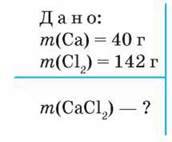
Р о з в ‘ я з а н н я
1. Визначимо тип задачі: задача “на надлишок”, тому що дано маси двох реагентів.
2. Напишемо рівняння реакції:
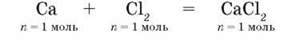
3. Запишемо відношення кількостей речовини реагентів за рівнянням реакції:
N(Са) : n(Cl2) = 1 : 1 (1)
4. Обчислимо n(Са) і n(Cl2) за даними задачі:
П(Cа) = m(Cа) : М(Cа) = 40 г : 40 г/моль = 1 моль; n(Cl2) = m(Cl2) : M(Cl2) = 142 г : 71 г/моль = 2 моль
5. Знайдемо їх співвідношення:
N(Са) : n(Cl2) = 1 : 2 (2)
6. Порівняємо співвідношення (1) і (2) й визначимо речовину, яка в надлишку і за якою робитимемо розрахунки:
N(Са) : n(Cl2) = 1 : 1 (за рівнянням реакції); n(Са) : n(Cl2) = 1 : 2 (за умовою задачі)
У надлишку – Cl2, повністю прореагує Cа, тому розрахунки маси СаC2 робитимемо за Cа.
7. Обчислимо масу кальцій хлориду за рівнянням реакції:
M(CaCl2) = m(CaCl2) – n(CаCl2) = 111 г/моль – 1 моль = 111 г
В і д п о в і д ь. Добуто 111 г CаCl2.
Задача 2. Обчисліть об’єм хлору (н. у.), який можна добути реакцією калій перманганату масою 6,32 г із хлоридною кислотою масою 2,19 г. При розв’язуванні цієї задачі речовину, яка повністю прореагує, визначаємо за способом 2.
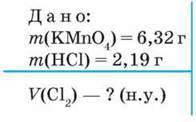
Р о з в ‘ я з а н н я
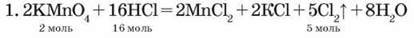
2. n(KMnO4) = m(KMnO4) : M(KMnO4) = = 6,32 г : 158 г/моль = 0,04 моль;
N(HCl) = m(HCl) : М(НCl) = 2,19 г : 36,5 г/моль = 0,06 моль.
3. Обчислимо n(HCl), що потрібне для реакції з 0,04 моль KMnO4: нехай n(HCl) = х, тоді 2 : 16 = 0,04 : х; х = 16 – 0,04 : 2 = 0,32 (моль).
Отже, для реакції з 0,04 моль KMnO4 потрібно 0,32 моль НCl; за умовою задачі n(HCl) = 0,06 моль: KMnO4 – у надлишку, НCl прореагує повністю. Розрахунки робимо за НCl.
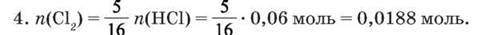
5. V(Cl2) = 22,4 л/моль – 0,0188 моль = 0,42 л.
В і д п о в і д ь. Добуто 0,42 л Сl2.
Алгоритм розв’язування задачі “на надлишок”
1. Визначити тип задачі.
2. Записати рівняння реакції, підписати під хімічними формулами відповідну кількість речовини.
3. Обчислити кількість речовини реагентів за умовою задачі.
4. Порівняти кількість речовини реагентів, що відповідають рівянню реакції та умові задачі, і визначити вихідну речовину, яка повністю прореагувала.
5. Обчислити кількість продукту реакції за рівнянням реакції.
Коротко про головне
Ознака задач на обчислення за рівнянням реакції, якщо один з реагентів узято в надлишку, – в умові дано значення маси, об’єму або кількості речовини обох реагентів. Обчислення здійснюють за тією речовиною, яка прореагувала повністю. Тому розв’язування задачі цього типу полягає у визначенні на основі розрахунків такої речовини.
Подальші обчислення маси, об’єму або кількості речовини продукту реакції здійснюють за рівнянням реакції відомими способами.