Оксиди Карбону
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ IVA ГРУПИ
§ 47. Оксиди Карбону
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати фізичні та хімічні властивості, способи добування і застосування оксидів Карбону;
Складати рівняння, схеми електронного балансу відповідних хімічних реакцій;
Висловлювати судження про вплив оксидів Карбону на довкілля.
Карбон згідно з характерними для нього ступенями окиснення +2 та +4 утворює два оксиди – СО і СО2, які мають кілька назв:
СО – карбон(ІІ) оксид,
СО2 – карбон(ІV) оксид, карбон діоксид, вуглекислий газ. Карбон(ІІ) оксид належить до несолетворних оксидів, карбон(ІV) оксид – до кислотних. Основні характеристики оксидів Карбону наведено у табл. 14.
Т а б л и ц я 14
Основні характеристики оксидів Карбону
Показники | Карбон(ІІ) оксид СО | Карбон(ІV) оксид СО, |
Відносна молекулярна і молярна маси | Мr (CO) = 28 M(CO) = 28 г/моль | Mr(CO2) = 44 M(CO2) = 44 г/моль |
Структурна та електронна формули | С=О,:С:::О: | О=С=О, :О::С::О: |
Ступінь | +2 | +4 |
Валентність Карбону | ІІІ | ІV |
Хімічні зв’язки між атомами | Ковалентний Полярний, Потрійний | Ковалентні полярні, подвійні |
Просторова будова молекули | Лінійна | Лінійна |
Тип кристалічної гратки | Молекулярна | Молекулярна |
Температура плавлення, °С | -205 | -56,6 при р = 520 кПа |
Температура кипіння, °С | -192 | -78,5 (t сублімації) |
Розчинність у воді, мл на 100 г води за н. у. | 3,5 | 171 |
Відносна густина за повітрям | 0,97 | 1,52 |
Карбон(ІІ) оксид, або чадний газ СО. Фізичні властивості. За стандартних умов – це безбарвний, отруйний газ, без запаху і смаку, трохи легший за повітря. Молекула лінійна і малополярна (мал. 77), подібна до молекули азоту. Термічно стійкий, малорозчинний у воді, плавиться й кипіть за низьких температур.
– Поміркуйте, де накопичуватиметься чадний газ під час утворення в приміщенні.
Фізіологічна дія. Чадний газ є токсичним! Потрапляє в атмосферу внаслідок спалювання пального, роботи автомобільного транспорту. Концентрація СО в повітрі 1 г/м3 є небезпечною для життя людини. Оскільки ін не має запаху, людина не може його виявити. Потрапляння карбон(ІІ) оксиду в організм передусім згубно впливає на мозок. Він утворює стійку сполуку з гемоглобіном крові, внаслідок чого припиняється перенесення кисню від легенів до тканин, і настає кисневе голодування. У людини з’являється сильний головний біль, вона непритомніє і навіть може померти. Хронічне отруєння чадним газом, пов’язане з професійною діяльністю або тютюновим димом, призводить до руйнування кровоносних судин. Чадний газ згубно впливає на дитину в лоні матері, бо вони мають спільну кровоносну систему. Після одноразового і повторного отруєння вагітних жінок чадним газом ще ненароджена дитина може померти, а немовлята, які зазнали впливу СО, народжуються з фізичними вадами або затримкою психомоторного розвитку. Перша допомога при отруєнні чадним газом – свіже повітря, штучне дихання, при важкому отруєнні – переливання крові.

Мал. 77. Модель молекули СО
Добування карбон(ІІ) оксиду в промисловості здійснюють у спеціальних печах – газогенераторах. У таких печах відбуваються дві реакції: горіння коксу з утворенням вуглекислого газу і відновлення вуглекислого газу коксом до чадного газу (див. § 46):
С + О2 = СО2; С + СО2 = 2СО
Газова суміш, що виходить з печі, містить чадний газ, залишки вуглекислого газу й азот. Цю суміш називають генераторним газом.
– Порівняйте склад генераторного і водяного газів (див. § 47).
Таким чином, у газогенераторі відбувається перетворення твердого палива (коксу) на газувате. Цей процес, як і утворення водяного газу, називають газифікацією твердого палива.
Хімічні властивості. Карбон монооксид, як і азот, хімічно інертна речовина. Будучи несолетворним оксидом, не реагує з водою, лугами і кислотами, але вступає в окисно-відновні реакції. Оскільки ступінь окиснення Карбону в оксиді становить +2, а найхарактернішим для Карбону є +4, то карбон(ІІ) оксид є активним відновником. Реакції за його участю відбуваються за підвищених температур і тиску.
Горіння чадного газу в кисні супроводжується синім полум’ям і виділенням великої кількості теплоти, хоча на початку реакції суміш нагрівають до 700 °С:
2СО + О2 = 2СО2, ∆Н = -566 кДж Горіння карбон(ІІ) оксиду можна спостерігати, запаливши сірник. Синє забарвлення нижньої частини полум’я зумовлене горінням чадного газу, який утворюється при неповному згорянні деревини сірника.
Взаємодія з оксидами металічних елементів. СО відновлює більшість металічних елементів з їх оксидів:
3СО + Fe2O3 = 2Fe + 3CO2
– Для розглянутих реакцій складіть схеми електронного балансу. Застосування. Чадний газ у складі генераторного і водяного газів використовується як паливо та сировина в синтезі амоніаку, спиртів, для добування водню. Завдяки відновним властивостям застосовують у металургії під час виплавляння чавуну, добування металів з руд.
Карбон(ІV) оксид, або вуглекислий газ СО2. Фізичні властивості. За стандартних умов газ безбарвний, без запаху, зі слабким кислим смаком, не підтримує дихання та горіння, в 1,5 раза важчий за повітря.
– Поміркуйте, де накопичуватиметься вуглекислий газ при його утворенні в приміщенні.

Мал. 78. Модель молекули СО2 (а), “сухий лід” (б)
Молекула лінійної будови, неполярна (мал. 78, а). Карбон(ІV) оксид термічно стійкий. Температури плавлення і кипіння низькі, але вищі, ніж у чадного газу. При випаровуванні рідкого вуглекислого газу відбувається його сильне охолодження й частина газу перетворюється на снігоподібну масу – “сухий лід”. З підвищенням температури сухий лід не плавиться, а знову переходить у газуватий стан (мал. 78, б). Нагадаємо, що це явище називається сублімацією.
– Поясніть, які особливості будови йоду та вуглекислого газу зумовлюють їх здатність до сублімації.
Зверніть увагу, що вуглекислий газ краще, ніж чадний, розчиняється у воді, хоча його молекула, на відміну від молекули води, неполярна. Пояснюється це тим, що вуглекислий газ взаємодіє з водою, утворюючи карбонатну кислоту.
Розчинність вуглекислого газу з підвищенням тиску зростає, а з підвищенням температури навпаки – знижується. Його розчини у воді загальновідомі – це газовані напої.
Фізіологічна дія. Токсичний вплив вуглекислого газу на організм людини виявляється в подразненні шкіри й слизових оболонок. У відносно малих кількостях вуглекислий газ збуджує дихальний центр мозку, а в дуже великих – пригнічує. Високий вміст вуглекислого газу в повітрі (більше 0,25 % за об’ємом) у поєднанні з пониженим вмістом кисню спричиняє смерть. Профілактика отруєння вуглекислим газом у побуті й на виробництві передбачає інтенсивне провітрювання місць накопичення газу.
У масштабах Землі вуглекислий газ пов’язаний з “парниковим ефектом”. Про це явище йтиметься далі.
Добування. У промисловості вуглекислий газ добувають випалюванням вапняку, а в лабораторії – дією на нього хлоридної кислоти. Однак вуглекислий газ є продуктом багатьох хімічних процесів, які відбуваються в промисловості, лабораторії та у природі (табл. 15).
– Порівняйте дві реакції добування карбон(ІV) оксиду з вапняку. Поясніть, чому одну з них використовують у лабораторії, а іншу – в промисловості.
Збирають карбон діоксид, добутий у лабораторії, способом витіснення повітря, нахиляючи склянку дном донизу.
Утворення карбон(ІV) оксиду
У промисловості, побуті | У лабораторії | У природі |
Як побічний продукт: – у виробництві негашеного вапна: CaCO3 = СаО + CO2 – при спалюванні палива: СН4 + 2O2 = CO2 + 2Н2 O | CaCO3 + 2HCl = CaCl2 + H2C03 Н20 CO2 | При повільному окисненні під час біохімічних процесів (дихання, гниття, бродіння) |
Хімічні властивості. Як кислотний оксид вуглекислий газ виявляє властивості цього класу сполук: реагує з водою з утворенням карбонатної кислоти, основними оксидами й основами, утворюючи солі. Складіть рівняння відповідних реакцій у молекулярній та йонних формах.
Зазначимо, що при пропусканні добутого вуглекислого газу крізь вапняну воду (насичений і відфільтрований розчин кальцій гідроксиду) випадає білий осад; цією реакцією користуються для виявлення карбон(ІV) оксиду:
Са(ОН)2 + С02 = СаС03 + Н20
За високих температур вуглекислий газ виявляє окиснювальні властивості, наприклад у відомій вам реакції з вуглецем, реакції з магнієм (мал. 79):
2Mg + CO2 = 2MgO + С
Під дією сонячної енергії за його участю відбувається реакція фотосинтезу:
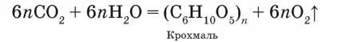
Застосування. Вуглекислий газ застосовується у виробництві соди, цукру, високо-ефективного мінерального добрива карбаміду (сечовина) СО(МН2)2 для гасіння пожеж, зберігання харчових продуктів (сухий лід), пригнічення процесів гниття; у приготуванні газованих напоїв.

Мал. 79. Горіння магнію у вуглекислому газі
Коротко про головне
Карбон утворює два оксиди – несолетворний карбон(ІІ) оксид (чадний газ) і кислотний карбон(ІV) оксид (вуглекислий газ). Фізичні властивості оксидів: безбарвні гази, без запаху, мають низькі температури плавлення і кипіння. Чадний газ отруйний, легший за повітря, не розчиняється у воді. Вуглекислий газ важчий за повітря, розчиняється у воді внаслідок взаємодії з нею, його температури кипіння і плавлення вищі, ніж у чадного газу. При випаровуванні цей газ переходить у твердий стан, обминаючи рідкий, і утворює “сухий лід” (явище сублімації). Хімічні властивості чадного газу пов’язані з його відновною здатністю, а карбон(ІV) оксиду – з приналежністю до класу кислотних оксидів і окиснювальною здатністю. Добувають чадний газ у газогенераторах у складі генераторного газу. Вуглекислий газ є побічним продуктом у виробництві негашеного вапна з вапняку, а в лабораторії його добувають взаємодією кальциту з хлоридною кислотою.