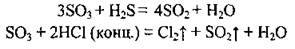Оксиди Сульфуру – Елементи VIA групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
9.3. Елементи VIA Групи
9.3.8. Оксиди Сульфуру
Сульфур(ІV) оксид
Сульфур утворює два оксиди – сульфур(ІV) оксид і сульфур(VІ) оксид. Найбільше значення серед сполук Сульфуру зі ступенем окиснення +4 має сульфур(ІV) оксид (сульфур діоксид, сірчистий газ) SO2. Має молекулярні кристалічні гратки. У його молекулі Сульфур утворює чотири ковалентні зв’язки:
Фізичні властивості і фізіологічна дія
Сульфур(ІV) оксид – безбарвний газ з різким задушливим запахом, отруйний. Тяжчий за повітря більш як удвічі. Добре розчиняється у воді. В одному об’ємі води розчиняється 40 об’ємівS02.
Сульфур(ІV) оксид – дуже токсична речовина, це один з найбільш небезпечних забруднювачів навколишнього середовища. Він потрапляє в повітря при спалюванні вугілля, окисненні сульфідних руд. У повітрі він взаємодіє з водяними парами, утворюючи сульфітну кислоту, яка разом з продуктом її окиснення – сульфатною кислотою – спричиняє появу кислотних дощів. Кислотні дощі
Добування сульфур(ІV) оксиду
Лабораторні способи:
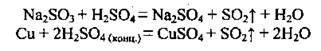
Промислові способи:
– спалювання сірки:
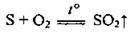
– випалювання піриту:
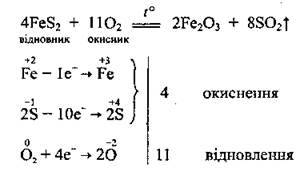
Хімічні властивості сульфур(ІV) оксиду
Сірчистий газ – це типовий кислотний оксид, якому відповідає сульфітна кислота.
1. Виявляє загальні властивості кислотних оксидів. Він взаємодіє з водою, утворюючи сульфітну кислоту, з основними та амфотерними оксидами, з основами, утворюючи два типи солей: кислі (гідрогенсульфіти) та середні (сульфіти):
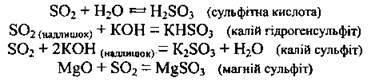
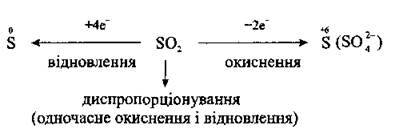
2. Сірчистий газ виявляє властивості як окисника, так і відновника. Ступінь окиснення Сульфуру в SO2 є проміжним (+4), а тому сульфур(ІV) оксид може бути і відновником, і окисником, а також може диспропорціонувати:
Реагуючи із сильнішими окисниками, SO2 виявляє відновні властивості:
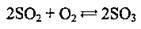
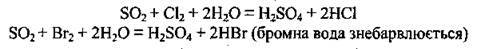
Реагуючи із сильним відновником, SO2 стає окисником:
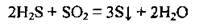
Сірчистий газ диспропорціонує, якщо його пропустити крізь гарячий концентрований розчин лугу:
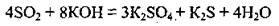
Відновні властивості в сульфур(ІV) оксиду виражені яскравіше.
Застосування
Сірчистий газ використовують для добування кальцій гідрогенсульфіту, який застосовують при переробці деревини на целюлозу. Сульфур(ІV) оксид необхідний для відбілювання текстильних виробів, знищення шкідників, щоб зберегти овочі і фрукти від плісняви і гнилісних мікробів. У значних кількостях сірчистий газ використовують для добування сульфатної кислоти. Також його використовують у текстильній промисловості для вибілювання тканин.
Сульфур(VІ) оксид
Сульфур(VІ) оксид (сульфур триоксид, сірчаний ангідрид) SO3 – це вищий оксид Сульфуру.
Фізичні властивості та фізіологічна дія
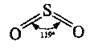
За стандартних умов – це безбарвна летка рідина з різким запахом, яка складається із циклічних тримерів (SO3)3. Це токсична речовина, яка уражає слизові оболонки і дихальні шляхи. За температури 16,8 °С твердне і перетворюється на прозору кристалічну масу. Окремі молекули в газоподібному стані мають форму плоского правильного трикутника. Усі атоми розміщені в одній площині. Валентні кути становлять 120°:
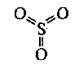
Добування сульфур(VІ) оксиду
Лабораторні способи:
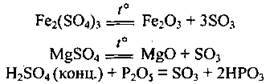
Промисловий спосіб (каталізатори – Pt, V2O5):
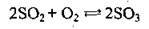
Хімічні властивості сульфур(VІ) оксиду
1. Сульфур(VІ) оксид виявляє загальні властивості кислотних оксидів: енергійно:реагує з водою, взаємодіє з основними та амфотерними оксидами, а також з гідроксидами, утворюючи кислі або середні солі:
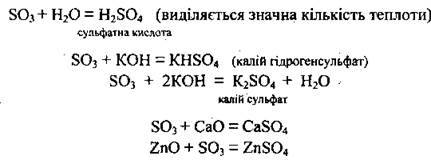
2. Сульфур(V) оксид розчиняється в безводній сульфатній кислоті, утворюючи олеум. Зазвичай олеум містить 18-20 % SO3 (іноді до 60 %).
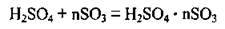
Олеум містить і піросульфатні кислоти:
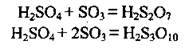
3. Сульфур(VІ) оксид виявляє сильні окисні властивості, тому що Сульфур у цій сполуці має максимальний ступінь окиснення: