ОКСИГЕН І КИСЕНЬ. ПОШИРЕНІСТЬ ОКСИГЕНУ І КИСНЮ В ПРИРОДІ. ФІЗИЧНІ ВЛАСТИВОСТІ КИСНЮ
Тема 2 КИСЕНЬ
& 22. ОКСИГЕН І КИСЕНЬ. ПОШИРЕНІСТЬ ОКСИГЕНУ І КИСНЮ В ПРИРОДІ. ФІЗИЧНІ ВЛАСТИВОСТІ КИСНЮ
Вивчення параграфа допоможе вам:
· характеризувати хімічний елемент Оксиген;
· описувати поширеність Оксигену й кисню в природі;
· дізнатись про історію відкриття кисню;
· описувати фізичні властивості кисню;
· називати склад оксидів та наводити їх приклади
ХІМІЧНИЙ ЕЛЕМЕНТ ОКСИГЕН. За періодичною системою хімічних елементів з’ясовуємо, що Оксиген розміщений у VI групі, 2-му періоді. Його
Який заряд має ядро атома Оксигену? Скільки протонів і нейтроні, міститься в атомі Оксигену з відносною атомною масою 16? Яка кіль кість електронів в атомі Оксигену?
Оксиген має постійну валентність II і є винятком з правила про те, що номер групи вказує на максимальну валентність елемента. Він утворює сполуку з Гідрогеном, у молекулі якої міститься 2 атоми Гідрогену й 1 атом Оксигену, тобто воду Н2О.
Чи поширюється на цю сполуку правило визначення валентності у бінарних сполуках неметалічних елементів з Гідрогеном, за яким потрібно від 8 відняти
КИСЕНЬ ТА ОЗОН – ПРОСТІ РЕЧОВИНИ ОКСИГЕНУ. Ви вже знайомі з тим, що ці дві прості газоподібні речовини Оксигену мають різний кількісний склад, тому й неоднакові формули: у кисню – О2 в озону – О3. Але цим відмінності не вичерпуються. Розгляньте таблицю 7 і з’ясуйте, чим ще відрізняються прості речовини Оксигену.
Таблиця 7
Порівняння кисню й озону
№ | Характеристики | Прості речовини | |
Кисень | Озон | ||
1 | Хімічна формула | О2 | |
2 | Відносна молекулярна маса | 32 | 48 |
3 | Колір | Безбарвний | Блакитний |
4 | Запах | Немає | Запах свіжості |
5 | Знаходження на Землі | Найбільше у нижніх шарах атмосфери | Найбільше на висоті 15-25 км, де він утворює озоновий шар |
6 | Значення в живій природі | Дихання організмів | Поглинання небезпечного для організмів випромінювання Сонця |
Назва “озон” у перекладі з грецької означає “той, що пахне”. У невеликій кількості озон утворюється під час грози.
ОКСИДИ ЯК ПРЕДСТАВНИКИ СКЛАДНИХ РЕЧОВИН ОКСИГЕНУ. Оксиген існує в природі не лише у вигляді простих речовин кисню та озону, а й у вигляді складних речовин, серед яких багато оксидів.
Оксиди – бінарні сполуки елементів з Оксигеном (за невеликим винятком).
Утворювати оксиди здатні металічні і неметалічні елементи. Для неметалічних елементів номер групи у періодичній системі за невеликим винятком збігається з максимальним значенням валентності в оксидах.
Поміркуйте. Складіть формула оксидів Натрію, Цинку, Алюмінію, Силіцію (ІV), Феруму( III ), Нітрогену (II) і Нітрогену (IV ). Відшукайте, у яких формулах валентність елемента збіглась з номером групи.
ПОШИРЕНІСТЬ ОКСИГЕНУ В ПРИРОДІ. Не існує жодного хімічного елемента, якого у природі більше, ніж Оксигену. За загальними підрахунками оболонки Землі (літосфера, гідросфера, атмосфера) в сумі майже наполовину складаються з Оксигену.
Пригадайте з географії, які оболонки Землі називають літосферою, атмосферою, гідросферою.
Складних оксигеновмісних речовин існує величезна кількість, починаючи з води і закінчуючи органічними сполуками – білками, що мають найскладнішу будову і великі відносні молекулярні маси.
За мал. 59 параграфа 14 поновіть у пам’яті вміст (за масою) різних елементів у природі.
З малюнку бачимо, що вміст Оксигену становить близько 49 %. Навіть другий за поширеністю у природі елемент Силіцій поступається йому майже вдвічі. Вміст Оксигену в атмосфері за об’ємом вам відомий з попереднього параграфа. За масою Оксигену в атмосфері дещо більше – 23 %.
Обчисліть масову частку Оксигену у воді за її хімічною формулою.
В результаті проведених обчислень ви отримаєте відповідь – 0,89. Це означає, що 89 % складу води океанів, морів, річок та інших водойм становить Оксиген! У тілах живих істот налічується до 65 % (за масою) Оксигену, що входить до складу вуглеводів, жирів, білків, води.
У вигляді простої речовини кисню Оксиген наявний у повітрі. Завдяки зеленим рослинам у повітрі підтримується постійний вміст кисню, незважаючи на великі його витрати на дихання та гниття, згоряння палива у двигунах різних машин” літаків тощо.
Найпоширенішими оксидами на Землі є гідроген оксид, або вода Н2О, силіцій (ІV) оксид SiO2 – основна складова частина піску та граніту, алюміній оксид Аl2O3, що входить до складу глини, ферум(ІII) оксид Fe2O3, (міститься у залізних рудах) та інші.
Які оксиди із назначених вище утворені метaлічними, а які – не металічними хімічними елементами?
Розгляньте малюнок 78, назвіть речовини, у складі яких перебував Оксиген у зображених на ньому тілах природи.
Оксиген – найпоширеніший елемент на Землі.
У природі переважна більшість Оксигену перебуває у сполуках з іншими елементами.
ІСТОРІЯ ВІДКРИТТЯ КИСНЮ. Порівняно з багатьма іншими речовинами кисень відкрили доволі пізно. Перешкоджала цьому тотожність багатьох властивостей кисню властивостям повітря (відсутність кольору, запаху, погана розчинність у воді). Відкриття здійснили відразу три вчені.
У 1771 р. кисень відкрив шведський вчений Карл-Вільгем Шеєле. Він прожарював селітру із сульфатною кислотою і потім розкладав отриманий оксид Нітрогену, про що описав у книзі, виданій у 1777 році. Вчений назвав цей газ “вогняним повітрям”.


Мал. 78. Поширеність Оксигену в природі
У 1774 р. французький хімік Антуан Лоран Лавуазьє, провівши досліди з нагрівання меркурій(ІІ) оксиду НgO, зробив висновок, що газ, який виділявся при цьому, міститься у повітрі і теж підтримує горіння. Одержаний газ він назвав “надзвичайно чистим повітрям”, а пізніше – оксигеном. Та А. Лавуазьє не зробив ніяких повідомлень про своє відкриття, а обмежився лише записом у щоденнику.
В тому самому 1774 р. англійський хімік і філософ Джозеф Прістлі, нічого не знаючи про відкриття попередників, відкрив кисень з тієї ж речовини, що й А. Лавуазьє, і зробив про це повідомлення. Тому з приводу того, хто перший відкрив кисень, між вченими виникла навіть дискусія. Закінчилась вона тим, що в науці першість відкриття кисню закріпилася за К. Шеєле і Д. Прістлі, а назви – за А. Лавуазьє.
ФІЗИЧНІ ВЛАСТИВОСТІ КИСНЮ О2. Фізичні та хімічні властивості кисню добре досліджені. Кисень – газ без кольору, смаку та запаху, трохи важчий за повітря. Для порівняння зазначимо, що 1 л повітря важить 1,29 г, тоді як 1 л кисню – 1,43 г. Кисень погано розчиняється у воді. Так, він води його розчиняється лише 0,01 г(або 30 мл). При охолодженні до -183 С газоподібний кисень перетворюється на рідину світло-блакитного кольору(мал. 79а). Саме у цей колір фарбують балони, у яких транспортують стиснений кисень (мал. 79б). Для переведення рідкого кисню у твердий агрегатний стан потрібне охолодження до -218 °С. Твердий кисень зовні нагадує кристали льоду блакитного кольору.
Скарбничка ерудита
“Вогняне повітря”, “дефлогістоване повітря”, “очищене повітря”, “життєвий газ”, “райський газ” – як тільки не називали просту речовину – кисень – до того, як Антуан Лоран Лавуазьє назвав його оксигеном – тим, що породжує кислоти. Нині ця назва в українській науковій термінології збереглася за хімічним елементом із зарядом ядра атома +8. тоді як проста речовина дістала назву “кисень”.

Мал. 79. Рідкий кисень (а) та балони зі стисненим кмснем(б)
?
1. Охарактеризуйте хімічний елемент Оксиген, скориставшись відомостями про нього з періодичної системи хімічних елементів.
2. Що вам відомо про поширеність Оксигену і кисню в природі?
3. Опишіть історію відкриття кисню.
4. Схарактеризуйте фізичні властивості кисню.
5. Які речовини називають оксидами? Серед наведених формул укажіть формули оксидів: NaH, KNO3, Na2О, CuO, CuCl2, Mg(OH)2, ZnO.
6. Порівняйте масові частки Оксигену у сульфур(IV) оксиді та фосфор(V) оксиді.
7. Складіть формули оксидів за валентністю:
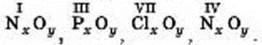
На підставі одержаних знань про повітря і кисень, висловіть судження про значення проварювання приміщень. Спершу визначте об’єм класної кімнати та обчисліть, яка маса кисню перебуває в ній. Зважаючи на те. що людина в середньому за добу споживає 700 г кисню, з’ясуйте приблизну масу кисню, яку учні вашого класу вдихають за 6 годин перебування в класі. На скільки діб вистачило б цього кисню учням вашого класу у разі повної герметизації вікон і дверей класної кімнати?