Оксиген, Сульфур. Алотропні модифікації. Сполуки оксигену та сульфуру – Неметали
Хімія
Неорганічна хімія
Неметали
Якщо в Періодичній системі умовно провести лінію по діагоналі від Бора до Астату, то праворуч угорі в головних підгрупах будуть розташовані елементи-неметалИ. До них належать: Гідроген, Гелій, Бор, Карбон, Нітроген, Оксиген, Флуор, Неон, Силіцій, Фосфор, Сульфур, Хлор, Аргон, Арсен, Селен, Бром, Криптон, Телур, Йод, Ксенон, Астат, Радон.
Оксиген, Сульфур. Алотропні модифікації. Сполуки оксигену та сульфуру
Оксиген, Сульфур
Елемент Оксиген Розташований в 2-му періоді, VI групі Періодичної системи.
Електронна конфігурація атома Оксигену:
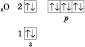

В атомі Оксигену два неспарені електрони, отже, він двовалентний. В Оксигену висока електронегативність, тому в сполуках для нього характерний ступінь окиснення –2, крім сполук із Флуором (ступінь окиснення +1 і +2) і пероксидів (ступінь окиснення –1).
Елемент Сульфур Розташований в 3-му періоді, VI групі Періодичної системи. Порядковий номер – 16. Відносна атомна маса – 32.
Електронна конфігурація атома Сульфуру:
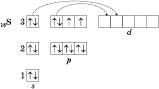

З урахуванням можливості переходу електронів з s – та p – підрівнів на вільний d-підрівень для Сульфуру в сполуках характерні ступені окиснення –2, +4, +6, рідше +2.
Алотропні модифікації Оксигену. У вільному стані Оксиген утворює дві алотропні модифікації: кисень
 і озон
і озон  .
.Властивості алотропних модифікацій Оксигену
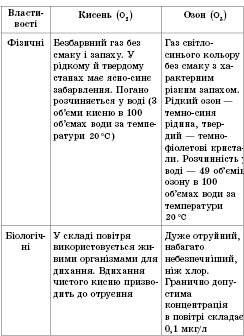
Алотропні модифікації Сульфуру. При кімнатній температурі Сульфур перебуває у вигляді
 -сірки (ромбічна модифікація), що являє собою жовті крихткі кристали без запаху, нерозчинні у воді. За температур вище
-сірки (ромбічна модифікація), що являє собою жовті крихткі кристали без запаху, нерозчинні у воді. За температур вище  відбувається повільне перетворення
відбувається повільне перетворення  -сірки в
-сірки в  -сірку (моноклінна модифікація), що є майже білими кристалічними пластинками.
-сірку (моноклінна модифікація), що є майже білими кристалічними пластинками.Поширення Оксигену в природі. Оксиген – найпоширеніший елемент на Землі. Його вміст у земній корі складає близько 55,1 %. Оксиген як хімічний елемент входить до складу води, мінералів (відомо понад 1400 мінералів, що містять Оксиген), органічних речовин.
Поширення Сульфуру в природі. У природі Сульфур зустрічається у вигляді самородної сірки (проста речовина); входить до складу сульфідів і сульфатів, що утворюють багато мінералів, є компонентом природного вугілля та нафти. Сульфур – життєво важливий елемент: він входить до складу білків.
Одержання алотропних модифікацій Оксигену та Сульфуру.
1) Кисень утворюється в результаті розкладання деяких солей:

пероксидів: 
оксидів важких металів: 
2) Озон утворюється зі звичайного кисню під дією електричного розряду (розряд блискавки, робота електротрансформаторів) або ультрафіолетового випромінювання (сонячне світло, робота ксерокса), а також у процесах, що супроводжуються виділення атомарного Оксигену (розклад пероксидів).
3) Сірку добувають в самородному стані; також її добувають:
при неповному розкладанні сірководню:

із сульфідів металів:

в реакціях відновлення сірки із сульфур(IV) оксиду:


Хімічні властивості кисню.
Кисень – сильний окисник.
1) Взаємодія з металами:

2) Взаємодія з неметалами:

3) Горіння складних речовин:

4) Окиснення складних речовин (цей процес не належить до горіння):

Хімічні властивості сірки.
1) При взаємодії з неметалами сірка виявляє окисні й відновлювальні властивості.
Із простими речовинами, утвореними більш електронегативними елементами (Оксигеном, Фтором, Хлором, Бромом), сірка виступає в ролі відновника.
 – сульфур(IV) оксид
– сульфур(IV) оксид
Із простими речовинами, утвореними менш електронегативними елементами, сірка виступає в ролі окисника:
 – карбон(VI) сульфід
– карбон(VI) сульфід
Бінарні сполуки сульфуру, в яких вона виявляє ступінь окиснення –2, називають сульфідамИ.
 – гідроген сульфід (сірководень)
– гідроген сульфід (сірководень)
2) Взаємодія з металами.
 – цинк сульфід;
– цинк сульфід;
 – ферум(ІІ) сульфід.
– ферум(ІІ) сульфід.
Усі сульфіди, крім HgS, утворюються при нагріванні. Із ртуттю сірка взаємодіє вже при кімнатній температурі:
 – меркурій(II) сульфід.
– меркурій(II) сульфід.
Ця властивість використовується в лабораторіях для видалення розлитої ртуті, пари якої дуже токсичні.
Застосування кисню. Кисень використовується для інтенсифікації процесів горіння (наприклад, при виплавці сталі), підвищення температури горіння (при зварюванні), як окисник в інших реакціях, у медицині.
Озон має дезинфікуючу відбілюючу дію. Головне застосування озону – знезаражування водопровідної води.
Застосування сірки. Сірка застосовується для одержання сульфатної кислоти, вулканізації каучуку, боротьби із сільськогосподарськими шкідниками, одержання сірників, пороху. У медицині виготовляють сірчані мазі для лікування шкірних хвороб.
Сульфур оксиди
Сульфур(IV) оксид  (діоксид сірки, сірчистий газ, сірчистий ангідрид) – безбарвний газ із різким запахом, скраплюється при
(діоксид сірки, сірчистий газ, сірчистий ангідрид) – безбарвний газ із різким запахом, скраплюється при  . Негорючий, легко розчиняється у воді. Водний розчин
. Негорючий, легко розчиняється у воді. Водний розчин  називають сульфідною кислотою.
називають сульфідною кислотою.
Міститься у вулканічних газах, виділяється при спалюванні природного вугілля. Є одним з основних забруднювачів повітря, викликає кислотні дощі.
Отруйний, викликає кашель, задишку, бронхіт, запалення легень.
Одержання сульфур(IV) оксиду.
1) Випалювання мінералів, що містять сульфіди:


2) Горіння сірки на повітрі: 
3) Горіння сірководню в надлишку кисню:  .
.
4) Взаємодія міді з концентрованою сульфатною кислотою:

5) Дія сульфатної кислоти на сульфіти:

Хімічні властивості сульфур(IV) оксиду. Для  більш характерні відновлювальні властивості.
більш характерні відновлювальні властивості.
1) Реакції, що відбуваються без зміни ступеня окиснення.
Взаємодія з основами:

Оборотна взаємодія з водою:

Взаємодія з основними оксидами:
 .
.
2) Реакції, що відбуваються з підвищенням ступеня окиснення від +4 до +6, наприклад:

3) Реакції, що проходять зі зниженням ступеня окиснення, наприклад:

Застосування сульфур(IV) оксиду. Основна маса сульфур(IV) оксиду витрачається на виробництво сульфатної кислоти та інших сполук Сульфуру. Використовується для відбілювання паперу, соломи і вовни. На відміну від необоротної дії білильного вапна, знебарвлення сульфур(IV) оксидом часто оборотне, і забарвлення повертається після промивання. Використовується як дезінфікуючий засіб, наприклад для обробки підвалів, овочесховищ.
Сульфур(VI) оксид  (сірчаний газ, ангідрид сульфатної кислоти) при кімнатній температурі – безбарвна рідина, температура кипіння
(сірчаний газ, ангідрид сульфатної кислоти) при кімнатній температурі – безбарвна рідина, температура кипіння  . Негорючий. Добре розчиняється у воді, взаємодіючи з нею. Гігроскопічний.
. Негорючий. Добре розчиняється у воді, взаємодіючи з нею. Гігроскопічний.
Токсичний, уражає дихальні шляхи, викликає опіки шкіри.
Одержання сульфур(VI) оксиду. Окиснювання  в присутності каталізатора (платина чи ванадій(V) оксид) при високому тиску й нагріванні:
в присутності каталізатора (платина чи ванадій(V) оксид) при високому тиску й нагріванні:

Хімічні властивості сульфур(VI) оксиду.
1) З’єднуючись із водою, утворює сульфатну кислоту:

2) Добре розчиняється в сульфатній кислоті, утворюючи важку маслянисту рідину – ОлеуМ:
 (або
(або 
3) У температурному інтервалі від 400 до  розкладається на сульфур(IV) оксид і кисень:
розкладається на сульфур(IV) оксид і кисень:

4) Як типовий кислотний оксид взаємодіє:
з оксидами, утвореними металами:

з основами:

Застосування сульфур(VI) оксиду. Сульфур(VI) оксид застосовується в основному у виробництві сульфатної кислоти; у лабораторії як водовід’ємний засіб.
Сульфатна кислота
Фізичні властивості сульфатної кислоти. Сульфатна кислота  – важка безбарвна масляниста рідина (стара назва сульфатної кислоти – купоросна олія). За звичайної температури вона не летка й не має запаху.
– важка безбарвна масляниста рідина (стара назва сульфатної кислоти – купоросна олія). За звичайної температури вона не летка й не має запаху.
Одержання сульфатної кислоти. Найбільше значення має контактний спосіб Одержання сульфатної кислоти. Процес складається з трьох стадій.
1) Одержання сульфур(IV) оксиду. Сировиною є сульфурвмісні руди, сірка, сірководень:
 ;
;  ;
;  .
.
2) Окиснення сульфур(IV) оксиду в сульфур(VI) оксид:  (реакція йде під тиском, при підвищеній температурі й у присутності каталізаторів).
(реакція йде під тиском, при підвищеній температурі й у присутності каталізаторів).
3) Одержання сульфатної кислоти. При цьому сульфур(VI) оксид поглинають розведеною сульфатною кислотою, одержуючи олеум, який потім розбавляють до потрібної концентрації:  (або
(або  ).
).
Хімічні властивості розведеної сульфатної кислоти. Сульфатна кислота як двоосновна кислота утворює два ряди солей: кислі – гідросульфати (утворюються при надлишку кислоти) і середні – сульфатИ.
1) Ступенева дисоціація:


2) Взаємодія з розчинними і нерозчинними основами (реакція нейтралізації). При цьому утворюються гідросульфати (якщо кислота в реакційній суміші в надлишку):

або сульфати (якщо немає надлишку кислоти в реакційній суміші):

3) Взаємодія з металами, що розташовані в електрохімічному ряді напруг до Гідрогену:

4) Взаємодія з оксидами металів:

5) Взаємодія із солями, утвореними більш слабкими і/або леткими кислотами:

Хімічні властивості концентрованої сульфатної кислоти.
1) Взаємодія з металами. Концентрована сульфатна кислота при нагріванні реагує з багатьма металами, у тому числі тими, що стоять в електрохімічному ряді напруг після Гідрогену. При цьому виділяється не водень, а сульфур(VI) оксид (з менш активними металами), сірка (з металами середньої активності) або сірководень (з активними металами):



Алюміній, залізо і хром пасивуються концентрованою сульфатною кислотою на холоді, при нагріванні реагують із нею.
2) Безводна сульфатна кислота розчиняє до 70 % сульфур(VI) оксиду, при цьому утворюється олеум.
3) При нагріванні відщеплює сульфур(VI) оксид доти, поки не утвориться розчин із масовою часткою сульфатної кислоти 98,3 %:

4) Обвуглює органічні речовини – цукор, папір, дерево.
5) Як сильна нелетка кислота витісняє інші кислоти з їхніх сухих солей:

Реактивом для виявлення сульфат-іонів є розчини, що містять йони Барію:

Барій сульфат, що утворюється,- білий порошкоподібний осад, нерозчинний у воді й кислотах.
Застосування сульфатної кислоти. Сульфатна кислота використовується у виробництві неорганічних кислот, лугів, солей, мінеральних добрив, вибухових речовин, штучних волокон, барвників, пластмас і багатьох інших речовин. Найбільша кількість її витрачається для одержання фосфатних і нітратних добрив. Сульфатну кислоту використовують для одержання інших кислот – хлоридної, флуороводневої, фосфатної, оцтової. Вона застосовується для очищення нафтопродуктів.