Параметри термодинамічної системи. Стан системи. Процес
ФІЗИКА
Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
Розділ 7 ОСНОВИ ТЕРМОДИНАМІКИ
7.1. Параметри термодинамічної системи. Стан системи. Процес
Термодинаміка вивчає фізичні процеси з погляду перетворення енергії, що відбувається в них з урахуванням двох форм її передавання: роботи та теплообміну. Проте, на відміну від молекулярно-кінетичної теорії, термодинаміка вивчає макроскопічні властивості тіл і явищ природи, залишаючи поза увагою їхню внутрішню будову. Не розглядаючи молекул і атомів, обминаючи мікроскопічний розгляд
Термодинаміка грунтується на кількох фундаментальних законах, які називають принципами термодинаміки і які є узагальненням результатів численних дослідних фактів. Унаслідок цього висновки термодинаміки мають досить загальний характер.
Термодинаміка розглядає широке коло явищ. Закони термодинаміки можна застосовувати до процесів, що відбуваються у гальванічних елементах, до магнітних явищ, процесів усередині зірок та ін. Взагалі немає такої галузі фізики й хімії, в якій не можна було б застосувати термодинамічний метод. Бурхливий
Термодинамічна система складається з тіл, взаємодія яких із середовищем полягає в обміні енергією через роботу та через нагрівання. Середовищем вважаються всі тіла, що оточують систему, але до її складу не входять. Прикладом термодинамічної системи може бути газ або вода і пара над нею в закритій посудині.
Фізичний стан системи характеризується сукупністю числових значень фізичних величин, якими визначаються властивості системи. Такими величинами є тиск, температура, об’єм, діелектрична проникність, показник заломлення світла тощо.
У термодинаміці для характеристики стану системи звичайно користуються такими трьома величинами: тиском р, об’ємом V і температурою Т. Ці величини називаються параметрами термодинамічної системи. При цьому параметри можуть бути внутрішніми, які стосуються цієї системи, і зовнішніми, що характеризують зовнішні тіла. Наприклад, об’єм газу вважається зовнішнім параметром, оскільки він залежить від розмірів посудини. Тиск газу – внутрішній параметр, він залежить від середньої кінетичної енергії молекул. Для характеристики термодинамічного стану сумішей використовують параметр, що називається концентрацією. Параметри стану зв’язані між собою так, що при зміні одного з них змінюється принаймні ще один. Зв’язок між параметрами стану термодинамічної системи можна виразити, як зазначалося раніше, рівнянням стану. У найпростішому випадку для ідеального газу залежність між об’ємом, тиском і температурою виражається рівнянням Менделєєва – Клапейрона. Якщо параметри стану термодинамічної системи мають цілком певне значення і з часом не змінюються при незмінних зовнішніх умовах, то така система перебуває в стані рівноваги. Коли ж параметри стану змінюються з часом, то в системі відбувається термодинамічний процес. Прикладом термодинамічного процесу може бути зміна об’єму газу, що супроводжується зміною тиску й температури.
Рівноважний стан системи можна зобразити графічно точкою на площині з прямокутними координатами, якщо відкласти по координатних осях значення будь-яких двох параметрів. Нерівноважний стан не можна так показати, оскільки в цьому разі хоч один з параметрів не матиме певного значення.
Графічно можна зобразити тільки рівноважний стан системи. Якщо термодинамічний стан системи характеризується спочатку точкою А, а потім точками В і С на діаграмі, то це означає, що система перейшла з одного стану в інший (рис. 7.1). Отже, в системі відбувається певний процес.
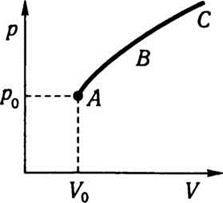
Рис. 7.1
Будь-який процес, тобто перехід системи з одного стану в інший, пов’язаний з порушенням рівноваги в системі. Отже, якщо в системі відбуватиметься будь-який процес, то вона проходитиме через послідовність нерівноважних станів.
Процес називають рівноважним, якщо система в будь-який момент часу перебуває в стані рівноваги. Практично до рівноважного процесу наближаються такі процеси, які відбуваються дуже повільно. Якщо в системі відбуватиметься такий процес, то система проходитиме через ряд нескінченно близьких один до одного станів, а точка, що зображає стан, переміщуватиметься по якійсь кривій (наприклад, по кривій АВС).
Оборотним називають такий процес, який відбувається в обох напрямах (наприклад, АВС-СВА) так, що система повертається у вихідне положення без будь-яких змін у навколишньому середовищі. Для необоротних процесів ця вимога порушується. В основу класифікації термодинамічних процесів можна покласти ознаку незмінності будь-якого з параметрів стану. Термодинамічний процес називають ізобарним, якщо залишається сталим тиск, ізохорним – коли не змінюється об’єм, ізотермічним – за сталої температури. Процес, що відбувається без теплообміну із зовнішнім середовищем, називають адіабатичним. Коловим процесом, або циклом, називають такий процес, при якому система виходить з якогось термодинамічного стану і, зазнавши змін, повертається до того самого стану.