Радикальне заміщення – Радикальні реакції
ОРГАНІЧНІ РЕАКЦІЇ
2. Радикальні реакції
Радикали мають високу реакційну здатність і в реакції з молекулами реагенту утворюють нові радикали, які у свою чергу утворюють нові радикали і т. д. У результаті відбувається ланцюгова реакція, в якій світло або теплова енергія, що поступає, дають лише “початковий поштовх”. Після запуску ланцюгової реакції радикалів вона може повторюватися декілька тисяч циклів.
2.1. Радикальне заміщення
Наочним прикладом радикального заміщення є хлорування метану, при якому атоми Гідрогену в молекулі метану заміщаються атомами Хлору. Цей процес проходить при опроміненні суміші газів світлом, що має велику енергію (наприклад, ультрафіолетовим світлом). Світлова енергія викликає гемолітичний розрив зв’язків молекули хлору з утворенням атомів Хлору.
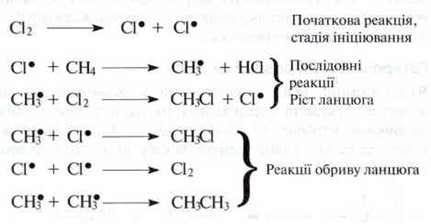
Цей механізм реакції пояснює причину низької концентрації етану в суміші похідних.
Related posts:
- РЕАКЦІЇ ЗАМІЩЕННЯ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ ЗАМІЩЕННЯ Реакції між простою і складною речовиною, в результаті яких атоми простої речовини заміщають атоми одного з елементів складної речовини, називаються реакціями заміщення. Наприклад: Рушійною силою реакцій заміщення є утворення більш міцних сполук. З хімічної точки зору чим активніший хімічний елемент, тим міцніші сполуки він утворює, і […]...
- Умови проходження реакцій заміщення – Електрофільне заміщення в заміщених аренів ОРГАНІЧНІ РЕАКЦІЇ 3. Іонні реакції 3.6. Електрофільне заміщення в заміщених аренів Умови проходження реакцій заміщення Багато молекул ароматичного ряду складаються з ароматичного й аліфатичного вуглеводневих залишків. В обох залишках атоми Гідрогену можуть заміщуватися атомами галогену. Яку похідну отримаємо, залежить від умов експерименту. – При застосуванні каталізатора молекула галогену зазнає гетеролітичного розриву. Іон галогену, що утворився, […]...
- Радикальна полімеризація – Радикальні реакції ОРГАНІЧНІ РЕАКЦІЇ 2. Радикальні реакції 2.2. Радикальна полімеризація Полімеризація – це реакція, в якій дуже багато молекул низькомолекулярних речовин – мономерів, – з’єднуються один з одним у довгі ланцюги – полімери. Реакція починається за участю стартера (ініціатора) – активної молекули, яка розпадається під дією світла на радикали. Ці радикали можуть “атакувати” подвійні зв’язки, причому щоразу […]...
- SN2-механізм – Нуклеофільне заміщення ОРГАНІЧНІ РЕАКЦІЇ 3. Іонні реакції 3.3 . Нукпеофільне заміщення SN 2- механізм При цьому нуклеофільному заміщенні процес проходить однорівнево. Нуклефіл ОН – атакує атом Карбону з боку, протилежного до атома Брому, що заміщується. В результаті атаки реалізується перехідний стан, в якому починає утворюватися зв’язок HO-С і одночасно починає розриватися зв’язок С-Вr. Нукпеофіл ОН-, що атакується […]...
- Реакції сполучення, розкладу, заміщення й обміну Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 22 Тема уроку. Реакції сполучення, розкладу, заміщення й обміну Цілі уроку: розвивати навички й уміння складати рівняння хімічних реакцій; формувати навички розпізнавання типів реакцій теоретично – за рівняннями реакції, експериментально – за ознаками хімічних реакцій. Тип уроку: формування вмінь і навичок. Форми роботи: фронтальне опитування, демонстраційний експеримент, групова робота, самостійна […]...
- Молекулярність реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції Згідно з теорією зіткнення, збільшення вдвічі кількості частинок реагенту в певному об’ємі веде до збільшення кількості зіткнень вдвічі і, відповідно, до збільшення швидкості реакції вдвічі. При збільшенні втричі концентрації частинок відбувається збільшення швидкості реакції втричі і т. д. 3.1 . Молекулярність реакції Реакції, в яких від початкових речовин […]...
- Швидкість хімічної реакції – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Швидкість хімічної реакції Хімічні реакції відрізняються одна від одної тривалістю їхнього протікання. Деякі хімічні реакції відбуваються миттєво (наприклад, вибух воднево-кисневої суміші, реакції обміну з утворенням осаду), інші – досить швидко (горіння речовин), треті – повільно (більшість реакцій […]...
- Орієнтація заміщення в заміщених аренів – Електрофільне заміщення в заміщених аренів ОРГАНІЧНІ РЕАКЦІЇ 3. Іонні реакції 3.6. Електрофільне заміщення в заміщених аренів Сполуки із замісником у бензеновому кільці можуть вступати в реакцію подальшого заміщення атомів Гідрогену – вторинного заміщення. При цьому можливе утворення трьох ізомерних структур: Розташування другого замісника значною мірою залежить від здатності першого замісника віддавати або відтягувати на себе електрони. Замісник, що віддає електрони, […]...
- Хімічні реакції Хімія Загальна хімія Хімічні реакції Перетворення речовин, що супроводжуються зміною їхнього складу і (або) будови, називаються хімічними реакціямИ. У хімічних реакціях З одних речовин виходять інші. Вихідні речовини, що вступають у хімічну реакцію, називаються реагентамИ, а нові, які утворюються внаслідок такої реакції, – продуктами Реакції. Хімічні реакції завжди супроводжуються фізичними ефектами, що називаються ознаками хімічної […]...
- БУДОВА ВУГЛЕВОДНІВ. 1. ГОМОЛОГИ – ОРГАНІЧНІ СПОЛУКИ Хімія – універсальний довідник ОРГАНІЧНІ СПОЛУКИ БУДОВА ВУГЛЕВОДНІВ. 1. ГОМОЛОГИ Найпростіша органічна сполука – вуглеводень метан СН4. У молекулі метану навколо атома Карбону симетрично розташовуються чотири атоми Гідрогену. Її просторову будову можна уявити тетраедром з атомом Карбону в центрі й атомами Гідрогену у вершинах. При заміщенні атомів Гідрогену на інші атоми (наприклад, Хлору в тетрахлорметані) […]...
- Ступінь окиснення – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції 1.2. Ступінь окиснення Водень і хлор реагують під час яскраво вираженої екзотермічної реакції, перетворюючись на гідроген хлорид: Н2 + Сl2 → 2НСl. Ця реакція також окисно-відновна, хоча в цьому випадку, власне, переходу електронів не відбувається. У молекулі гідроген хлориду атом Гідрогену зв’язаний з атомом Хлору спільною парою електронів. Щоб […]...
- Тепловий ефект реакції. Екзотермічні й ендотермічні реакції. Термохімічні рівняння Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 24 Тема уроку. Тепловий ефект реакції. Екзотермічні й ендотермічні реакції. Термохімічні рівняння Цілі уроку: розширити уявлення про хімічні реакції на прикладі ендотермічних і екзотермічних реакцій; ознайомити учнів з поняттями “тепловий ефект хімічної реакції”, “термохімічні рівняння”; формувати навички й уміння складати термохімічні рівняння реакцій, розв’язувати задачі з їх використанням. Тип уроку: […]...
- Швидкість хімічної реакції – Хімічні реакції Хімія Загальна хімія Хімічні реакції Швидкість хімічної реакції Швидкість хімічної реакції Визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. Формула середньої швидкості хімічної реакції: де – середня швидкість хімічної реакції, – зміна концентрації реагенту, – час. Чинники, що впливають на швидкість хімічної реакції 1) Природа реагуючих речовин. 2) Агрегатний стан реагуючих речовин. […]...
- СХЕМА ХІМІЧНОЇ РЕАКЦІЇ. РІВНЯННЯ ХІМІЧНИХ РЕАКЦІЙ № 1. Хімічне рівняння – це умовний запис хімічної реакції (хімічного явища) за допомогою хімічних формул, коефіцієнтів і знаків “+” “-” та “=”. Знак “=” вказує на те, що кількість атомів кожного хімічного елемента у лівій та правій частині хімічного рівняння однакова. № 2. Рівняння хімічної реакції відрізняється від її схеми тим, що у рівнянні […]...
- Чинники, що визначають швидкість реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.4 . Чинники, що визначають швидкість реакції Згідно з теорією зіткнення, реакція відбувається лише за певних умов: – частинки, які реагують між собою, повинні зіштовхнутися одна з одною; – частинки повинні зіштовхуватися в сприятливому для них положенні; – частинки повинні мати достатню кінетичну енергію, оскільки реакція проходить лише при […]...
- ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ Швидкість і механізм хімічної реакції вивчає хімічна кінетика. Швидкість хімічної реакції характеризується зміною концентрації однієї з вихідних речовин або кінцевих продуктів за одиницю часу. Середня швидкість реакції: Де с1 і с2 – початкова і кінцева концентрація речовини; τ1 і […]...
- Електрофільне заміщення ОРГАНІЧНІ РЕАКЦІЇ 3. Іонні реакції 3.4 . Електрофільне заміщення Характерною реакцією бензену й інших ароматичних сполук є електрофільне заміщення, при якому ароматична система зберігається: Електрофільне заміщення в ароматичних сполуках проходить у три етапи. 1-й етап: отримання активної електрофільної частинки (Х+) переважно за допомогою каталізатора. 2-й етап: електрофільна частинка “атакує” негативно заряджену π-електронну хмару бензену, утворюючи […]...
- SN1-механізм – Нуклеофільне заміщення ОРГАНІЧНІ РЕАКЦІЇ 3. Іонні реакції 3.3 . Нуклеофільне заміщення Атом галогену, сполучений з атомом Карбону, може легко витіснятися нуклеофілом у вигляді аніона, наприклад, гідроксид-іоном, який має електронну пару. Приклад. Монобромоетан реагує з водним розчином їдкого натру, утворюючи етанол: Реакція галогеноалканів з гідроксид-іоном може проходити двома різними шляхами. SN 1 – механізм Нуклеофільна реакція заміщення відбувається […]...
- Опис швидкості реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.3 . Опис швидкості реакції Швидкість реакції можна описати як зміну концентрації початкової речовини і як зміну продукту реакції за певний проміжок часу. І в одному і в іншому випадку за певний проміжок часу вона визначається за кутом нахилу січної відповідного графіка с(t). В один і той самий проміжок […]...
- Хімічні властивості метану та його гомологів ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина III. ОРГАНІЧНА ХІМІЯ Розділ 16. ВУГЛЕВОДНІ § 16.3. Хімічні властивості метану та його гомологів Члени гомологічного ряду алканів мають спільні хімічні властивості. Це малоактивні речовини. Усі реакції за їх участю можна розділити на два типи: реакції з розривом зв’язків С-Н (наприклад, реакції заміщення) та реакції […]...
- Хімічні властивості кислот. Реакції заміщення й обміну. Заходи безпеки під час роботи з кислотами. Використання кислот Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 19 Тема. Хімічні властивості кислот. Реакції заміщення й обміну. Заходи безпеки під час роботи з кислотами. Використання кислот Цілі уроку: закріпити знання про хімічні властивості кислот на прикладі хлоридної кислоти; поглибити знання учнів про реакції заміщення й обміну на прикладі хімічних властивостей кислот; розвивати навички експериментальної роботи з […]...
- Швидкість хімічної реакції – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач І. Швидкість хімічної реакції Формули і поняття, які використовуються: Де v1 – швидкість прямої реакції, V2 – швидкість зворотної реакції, A, Б – реагенти реакції, B, Г – продукти реакції, С(А), с(Б) – концентрації реагентів, С(В), […]...
- Хімічні властивості бензену: повне й часткове окиснення, приєднання, заміщення. Одержання й використання бензену І СЕМЕСТР Тема 2. ВУГЛЕВОДНІ Урок 17 Тема уроку. Хімічні властивості бензену: повне й часткове окиснення, приєднання, заміщення. Одержання й використання бензену Цілі уроку: формувати в учнів знання про хімічні властивості бензену та його похідних, про реакції приєднання й заміщення в бензольному кільці; розвивати вміння складати хімічні рівняння на прикладі властивостей бензену; ознайомити учнів з […]...
- Хімічні властивості аренів – АРОМАТИЧНІ ВУГЛЕВОДНІ (АРЕНИ) Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОРГАНІЧНА ХІМІЯ АРОМАТИЧНІ ВУГЛЕВОДНІ (АРЕНИ) Хімічні властивості аренів У зв’язку з тим, що утворення ароматичного зв’язку (трьох зв’язаних подвійних зв’язків у шестичленному циклі) є надзвичайно енергетично вигідним, для аренів майже не характерні реакції приєднання, попри те, що вони є ненасиченими сполуками. Для аренів […]...
- Визначення – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції У ході хімічної реакції кількість початкових речовин постійно зменшується, а кількість продуктів реакції відповідно збільшується. Зміну кількості початкових речовин чи продуктів реакції за певний проміжок часу називають швидкістю реакції. 2.1. Визначення Швидкість реакції v визначається як зміна кількості п речовини за певний проміжок часу: ∆n – зміна кількості речовини […]...
- Зв’язки в алкенах – Алкени та алкіни КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 1 . Вуглеводні 1.4 . Алкени та алкіни Алкени – вуглеводні, більш реакційно-здатні, ніж алкани. їх називають ненасиченими вуглеводнями, тому що вони можуть “поглинати” інші речовини, тобто приєднувати їх до себе під час хімічної реакції (електрофільне приєднання). Найпростішим представником алкенів є етен, молекулярна формула С2Н4. В етені – на відміну від етану […]...
- ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ – КИСЕНЬ Хімія – універсальний довідник КИСЕНЬ ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ Реакції, що супроводжуються виділенням теплоти, називаються екзотермічними. Наприклад, Реакції, що супроводжуються поглинанням теплоти, називаються ендотермічними. Наприклад, Кількість теплоти, що виділяється або поглинається в реакції, називається тепловим ефектом реакції. Тепловий ефект реакції ΔН – це різниця між вмістом енергії у вихідних речовинах і кінцевих продуктах реакції. Тепловий […]...
- Валентність Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ ЗАКОНИ Й ПОНЯТТЯ ХІМІЇ Валентність При утворенні молекули атоми не просто об’єднуються в якийсь безладний клубок, а зв’язуються в певній послідовності особливими хімічними зв’язками. Причому кожен атом може утворити не нескінченне, а тільки певне число таких зв’язків. У XIX столітті вчені встановили, […]...
- ЗАКОН ГЕССА. РОЗРАХУНОК ЕНТАЛЬПІЇ ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЗАКОН ГЕССА. РОЗРАХУНОК ЕНТАЛЬПІЇ ХІМІЧНОЇ РЕАКЦІЇ Тепловий ефект реакції залежить від початкового і кінцевого станів системи і не залежить від шляху реакції (закон Гесса). Наприклад: Кількість теплоти, яка виділяється під час спалювання метану СН4, не залежить від того, протікає реакція за одну стадію чи за дві […]...
- Іменні реакції в органічній хімії ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання ДОДАТКИ Додаток 17. Іменні реакції в органічній хімії Реакція Суть і схема реакції Застосування Бутлерова Синтез вуглеводів (гексоз) Вюрца Дія металічного натрію або калію на галогеноподібні насичені вуглеводні: Одержання алканів (подовження ланцюга) Зелінського Гідрогенізація циклогексану: Одержання бензену Зелінського-Казанського Тримеризація ацетилену: Одержання бензену Зініна Одержання ароматичних амінів Коновалова […]...