Реакція нейтралізації. Розкладання нерозчинних основ у процесі нагрівання
Тема 2
ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
УРОК 23
Тема. Реакція нейтралізації. Розкладання нерозчинних основ у процесі нагрівання
Цілі уроку: закріпити знання учнів про хімічні властивості основ; розвивати вміння й навички проведення хімічного експерименту складання рівнянь хімічних реакцій на прикладі хімічних властивостей лугів і нерозчинних основ.
Тип уроку: формування вмінь і навичок, урок-дослідження.
Форми роботи: лабораторна робота, робота з опорною схемою.
Обладнання: Періодична система хімічних елементів
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
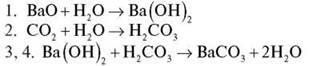
Робота з опорною схемою “Хімічні властивості основ”
– На основі знань про хімічні властивості основ заповнимо опорну схему “Хімічні властивості основ”.
– Згадаймо, яких правил необхідно дотримуватися в хімічній лабораторії.
(Звертаємося до таблиці “Правила техніки безпеки в кабінеті хімії”.)
III. Формування
Лабораторна робота № 4. Взаємодія розчинів лугів з кислотами
У дві пробірки наливаємо по 1 мл NaOH і по одній-дві краплі фенолфталеїну. Потім в одну з них по краплях додаємо хлоридну кислоту, у другу – сульфатну кислоту. Заносимо результати до протоколу.
Реагенти | Що спостерігаєте? | Рівняння реакції | Висновок |
NaOH | HCl | ||
NaOH | H2SO4 | ||
Cu(OH)2 | HCl |
Лабораторна робота № 5. Взаємодія нерозчинних основ з кислотами
Нам необхідно одержати купрум(ІІ) гідроксид. Як це зробити? Яку властивість основ для цього можна використати?
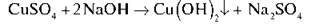
До одержаного осаду по краплях додаємо хлоридну кислоту.
– Які ознаки хімічної реакції спостерігаємо?
Запишіть результати досліду до протоколу.
Лабораторна робота № 6. Розкладання нерозчинних основ у процесі нагрівання
Нерозчинні основи за нагрівання розкладаються на оксид і воду. Перевіримо це на практиці.
Одержіть купрум(ІІ) гідроксид, закріпіть пробірку в пробірко-тримачі.
– Як правильно нагріти пробірку?
– В якій частині полум’я необхідно нагрівати пробірку? (У верхній, найбільш гарячій)
– Що спостерігаємо? Запишемо рівняння реакції:
Cu(OH)2 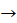 СuO + Н2O
СuO + Н2O
Укажіть тип реакції. (Реакція розкладу)
Висновок. З якими властивостями основ ми познайомилися на цьому уроці?
– Реакція нейтралізації.
– Розклад нерозчинних основ.
IV. Закріплення вивченого матеріалу
Керована практика
Завдання 1. Обчисліть кількість речовини води, що утвориться внаслідок нагрівання алюміній гідроксиду масою 15,6 г.
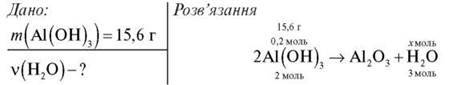
1) Обчислимо кількість речовини Аl(ОН)3 за формулою 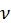 = m/M:
= m/M:
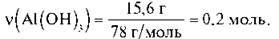
2) Складемо пропорцію й обчислимо кількість речовини води:
0,2 моль : 2 моль = х моль : 3 моль
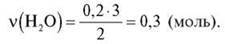
Відповідь: 0,3 моль.
Завдання 2. Здійсніть перетворення:
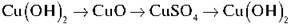
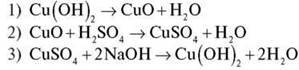
V. Домашнє завдання
Опрацювати відповідний параграф підручника, виконати завдання до нього.
Творче завдання. Підготувати повідомлення про використання основ.