Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок
Тема 1
РОЗЧИНИ
Урок 4
Тема уроку. Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок
Цілі уроку: формувати уявлення учнів про склад розчинів; ознайомити з властивостями води як універсального розчинника; розвивати знання про хімічний зв’язок і будову речовини на прикладі будови молекули води й поняття про водневий зв’язок.
Тип уроку: засвоєння нових знань.
Форми роботи: фронтальна бесіда.
Обладнання: таблиця розчинності, класифікація
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання.
Актуалізація опорних знань
Учні за бажанням зачитують творчі завдання.
– На які дві групи поділяються дисперсні системи?
– Які розчини називаються колоїдними?
– Які розчини називаються істинними?
– З яких компонентів складається розчин?
– Чи можна стверджувати, що розчини мають постійний склад? чому?
III. Сприйняття й первинне засвоєння нового матеріалу
Розчини – це багатокомпонентні системи. Один із компонентів називається розчинником.
У тому випадку, якщо одним із компонентів є вода, то саме вона й буде розчинником.
Вода – універсальний розчинник усіх речовин на Землі.
– Наведіть приклади водних розчинів.
– Наведіть приклади неводних розчинів.
За реакцією з водою всі речовини поділяються на три групи:
– розчинні;
– малорозчинні;
– практично нерозчинні.
Звертаємося до таблиці розчинності, згадуємо, як використовувати цю таблицю для визначення розчинності речовин у воді.
– Як можна пояснити таку особливість молекул води?
Звернемося до будови молекули води й розглянемо схему.
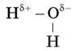
Тип зв’язку – ковалентний полярний, кут зв’язку – 104,5°.
Тип кристалічної гратки – молекулярний.
– Гратка молекулярна? Чому ж за нормальних умов вода – рідина?
Молекула води полярна – диполь. Між молекулами води виникає взаємне притягання за температури менш ніж 100 °С. Такий зв’язок називається водневим.
Розглядаємо схему водневого зв’язку між молекулами води.
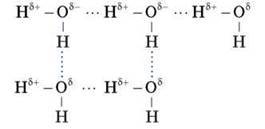
Такий зв’язок можливий між молекулами води й молекулами полярних розчинених речовин. Така особливість молекул води – одна з причин її розчинної сили.
IV. Закріплення знань, осмислення об’єктних зв’язків і відносин
Згадуємо властивості води (на підставі знань про воду заповнюємо опорну схему).
Молекулярна формула: ____________________
Структурна формула: _________________________
М(Н2О) =_________
Поширення в природі
В організмі людини: __________________
На Землі: __________________________
У Космосі: _________________________
Фізичні властивості
За атмосферного тиску 1 атм:
Ткип = 100 °С,
Тплав = 0 °С,
? = 1 г/см3.
Агрегатні стани: 
Хімічні властивості
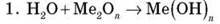 (якщо Ме – активний, а основа – розчинна або малорозчинна)
(якщо Ме – активний, а основа – розчинна або малорозчинна)
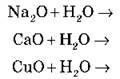
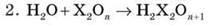 (крім SiO2)
(крім SiO2)
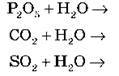
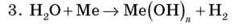 (якщо Ме – активний)
(якщо Ме – активний)
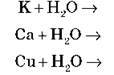
Завдання 1
Обчисліть масу води, що утворюється внаслідок згоряння водню об’ємом 1,12 л (за н. у.).
Обчисліть об’єм пари води цієї маси.
Завдання 2
Обчисліть масу лугу, що утворюється в процесі розчинення у воді калію масою 3,9 г.
V. Підбиття підсумків уроку
Учитель підбиває підсумки уроку, оцінює роботу учнів.
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Розв’язати задачу:
Обчисліть, яку масу сульфатної кислоти можна одержати з 3,2 г сірки.