Розчинність. Кристалогідрати – РОЗЧИНИ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
РОЗЧИНИ
Розчинність. Кристалогідрати
Розчинність – це властивість речовини розчинятися у воді або в якомусь іншому розчиннику.
За розчинністю речовини поділяють на розчинні, малорозчинні й нерозчинні. Однак слід зазначити, що абсолютно нерозчинних речовин не існує. Будь-яка речовина, навіть така як скло чи золото, у дуже малих кількостях розчиняється у воді.
Є речовини, які необмежено змішуються одна з одною, наприклад, етиловий спирт
У чому ж причина існування межі розчинності? Якщо перебувають у контакті вода й кристали якої-небудь розчинної речовини, то
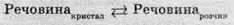
Коли концентрація цієї речовини в розчині вже збільшуватися не може, то розчин стає насиченим.
Насиченим називають розчин, який перебуває в динамічній рівновазі з надлишком розчиненої речовини.
Щоб приготувати насичений розчин, треба додавати речовину у воду при певній температурі, перемішуючи її доти, доки вона перестане розчинятися, тобто надлишок речовини залишиться нерозчиненим. У цьому разі між розчином і надлишком речовини виникає динамічна рівновага: скільки частинок речовини переходить у розчин, стільки ж і викристалізовується. У насиченому розчині при певній температурі міститься максимально можлива кількість розчиненої речовини.
Відповідно, якщо концентрація речовини менша за межу її розчинності, то такі розчини називають ненасиченими, а якщо більша – пересиченими. Пересичені розчини дуже нестійкі. Пересичені розчини можуть утворюватися, якщо насичений розчин обережно охолоджувати. При цьому розчинність речовини зменшується й надлишок її має випасти у вигляді осаду. Однак за відсутності центрів кристалізації осад не утворюється й, відповідно, розчин стає пересиченим. Легке струшування посудини або введення в розчин кристалика речовини (центра кристалізації) спричиняє випадання в осад надлишку розчиненої речовини. Пересичені розчини можуть утворювати сахароза, глауберова сіль, натрій ацетат, бура.
Кількісно розчинність виражають складом насиченого розчину. Найчастіше для кількісного опису розчинності використовують так званий коефіцієнт розчинності (або просто розчинність) – масу речовини, яка здатна розчинитися в 100 г води за певної температури. Наприклад, розчинність купрум(ІІ) сульфату при +20 °С дорівнює 20,7 г. Це означає, що в 100 г води при цій температурі може розчинитися не більше 20,7 г купрум(ІІ) сульфату. Надлишкова стосовно цієї кількості речовина не розчиниться й залишиться у вигляді осаду. Деякі речовини (такі як сульфатна кислота, етиловий спирт тощо) можуть необмежено розчинятися у воді. Однак таких речовин не так уже й багато (порівняно із числом речовин, які можуть розчинятися у воді). Розчинність багатьох речовин у воді встановлена й зведена в спеціальні таблиці. Спрощеною подібною таблицею є таблиця розчинності кислот, солей та основ.
Чим можна пояснити різну розчинність речовин у воді? Для цього необхідно розглянути причину розчинення. Молекула води являє собою диполь, тобто частинку, на різних кінцях якої є різнойменні заряди. Завдяки цьому молекули води можуть взаємодіяти із частинками іонних кристалів (іонами) або полярними молекулами. На підставі цього логічно припустити, що речовини з неполярними молекулами майже не розчиняються у воді, що ми й спостерігаємо: сахароза (полярна речовина) добре розчиняється у воді, сірка або бензен (неполярні речовини) майже не розчиняються у воді.
Але якщо воду розглядати як полярний розчинник, то виникає справедливе твердження, що існують також і неполярні розчинники. У принципі, будь-яку рідину можна розглядати як розчинник.
Усі розчинники можна класифікувати як полярні, малополярні й неполярні. Ця характеристика розчинників багато в чому визначається молекулою розчинника. До полярних розчинників належать: вода, спирти, ацетон, гліцерин тощо. До неполярних: бензен, гексан, октан тощо. До малополярних розчинників можна віднести естери органічних кислот. Такі речовини застосовуються як клей для пластмасових виробів (бутилацетат), харчова есенція із запахом дюшесу (ізоамілацетат) тощо.
Ще в алхімічний період становлення хімії був відкритий один із головних принципів, яким визначається розчинність речовин: подібне розчиняється в подібному.
Виходячи із цього принципу, можна пояснити, чому деякі речовини розчиняються в одному розчиннику й не розчиняються в іншому. Речовин, які розчинялися б абсолютно у всіх розчинниках – не існує. Так, полярні речовини добре розчиняються в полярних розчинниках, гірше розчиняються в малополярних і практично не розчиняються в неполярних. Наприклад, цукор добре розчиняється у воді й узагалі не розчиняється в бензені. І навпаки, неполярні речовини розчиняються в неполярних розчинниках і погано – у полярних. Наприклад, сірка не розчиняється (і навіть не змочується) у воді й добре розчиняється в бензені.
Кристалогідрати
Дуже часто при кристалізації деякі речовини не встигають (або їм це енергетично невигідно) позбуватися своєї оболонки з молекул води й кристалізуються разом з водою. Такі речовини називають кристалогідратами. Існування кристалогідратів є одним з доказів існування процесу сольватації. Наприклад, при розчиненні білого порошку купрум(ІІ) сульфату у воді утворюється розчин синього кольору. Такого кольору розчинові надають гідратовані іони Купруму Сu2+. При випарюванні цього розчину в осад випадають кристали синього кольору, до складу яких входить вода. Воду, яка входить до складу кристалів, називають кристалізаційною.
Кристалічні речовини, до складу яких входить певне число молекул кристалізаційної води, називають кристалогідратами.
Однак слід зазначити, що, на відміну від розчинів, у кристалогідратах кожну частинку речовини оточує тільки певна, властива цій речовині, кількість молекул води. У зв’язку із цим склад таких речовин можна однозначно встановити й записати хімічною формулою. Так, кристалогідрат купрум(ІІ) сульфату має склад CuSO4 ∙ 5Н2O.
Багато кристалогідратів мають власні назви. Наприклад, п’ятиводний купрум(ІІ) сульфат CuSO4 ∙ 5H2O називають мідним купоросом, десятиводний натрій сульфат Na2SO4 ∙ 10H2O – глауберовою сіллю, семиводний ферум(ІІ) сульфат FeSO4 ∙ 7H2O – залізним купоросом, двохводний кальцій сульфат CaSO4 ∙ 2H2O – гіпсом тощо.
Залежність розчинності речовин від їхньої природи, температури й тиску
Як і будь-який фізико-хімічний процес, процес розчинення підлягає певним закономірностям. Вище ми вже розглядали вплив температури й тиску на швидкість хімічних процесів. Аналогічно можна припустити, що ці параметри так само впливають на розчинність речовин.
Так, розчинність твердих і рідких речовин з підвищенням температури збільшується, а зі зниженням – зменшується. Для газуватих речовин характерна зворотна залежність: із підвищенням температури їхня розчинність зменшується, а зі зниженням – збільшується.
На розчинність речовин також впливає й зовнішній тиск. Оскільки при розчиненні твердих і рідких речовин загальний об’єм суттєво не змінюється, то зміна тиску на розчинність таких речовин майже не впливає. А при розчиненні газів загальний об’єм змінюється істотно, унаслідок чого при підвищенні тиску розчинність газів збільшується, а при зниженні – зменшується.
Взаємний вплив розчинювальних речовин
Якщо у воді вже розчинена яка-небудь речовина, то в цьому розчині гази розчиняються гірше, ніж у чистій воді. Найбільший вплив на розчинність газів у воді справляють розчинені електроліти. Так, розчинність кисню у воді в присутності натрій хлориду значно менша, ніж у чистій воді, причому розчинність суттєво зменшується з підвищенням концентрації солі. Сьогодні це явище називають законом Сєченова.
Зменшення розчинності в присутності інших речовин характерне не тільки для газів. Наприклад, якщо до насиченого розчину калій хлориду додати невелику кількість натрій хлориду, то розчинність калій хлориду зменшується й частина речовини випадає в осад. Це явище називають висолюванням.
Зниження розчинності речовин у розчинах електролітів обумовлене гідратацією іонів, що спричинює зменшення концентрації вільних молекул води. Частина молекул води, яка вже зв’язана з іонами електроліту, не може вступати в процес сольватації інших частинок і, відповідно, не є розчинником для інших речовин.