Розчинність речовин у воді – РОЗЧИНИ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
§ 5.2. Розчинність речовин у воді
Розчинність – це властивість речовини розчинятися у воді або іншому розчиннику. У воді можуть розчинятися тверді, рідкі й газуваті речовини.
За розчинністю у воді всі речовини поділяються на три групи: 1) добре розчинні; 2) малорозчинні і 3) практично нерозчинні. Останні називаються також нерозчинними речовинами. Однак слід зазначити, що абсолютно нерозчинних
З наведених
Процес розчинення твердих речовин у рідинах можна подати так: під впливом розчинника від поверхні твердої речовини поступово відриваються окремі – іони або молекули і рівномірно розподіляються в усьому об’ємі розчинника. Якщо розчинник контактує з великою кількістю речовини, то через деякий час розчин стає насиченим.
Насиченим називається такий розчин, який перебуває в динамічній рівновазі з надлишком розчиненої речовини.
Щоб приготувати насичений розчин, потрібно у воду за даної температури додавати при перемішуванні речовину доти, доки не утвориться осад, тобто надлишок речовини залишиться нерозчинним. У Цьому випадку встановиться динамічна рівновага між розчином і надлишком речовини, що розчиняється: скільки частинок речовини переходитиме в розчин, стільки само їх буде виділятися (кристалізуватися) з розчину. В насиченому розчині за даної температури міститься максимально можлива кількість розчиненої речовини.
У ненасиченому розчині міститься менше речовин, а в пересиченому – більше, ніж у насиченому. Пересичені розчини досить нестійкі. Легке струшування посудини або додавання до розчину кристала солі спричиняє випадання в осад надлишку розчиненої речовини. Пересичені розчини утворюють сахароза, Na2SO4 ∙ 10Н2О, Nа2S2О3 ∙ 5Н2О, СН3СООNа, Na2B4O7 ∙10Н2О та ін.
Часто малорозчинні і практично нерозчинні речовини об’єднують однією назвою – малорозчинні. В цьому разі говорять тільки про розчинні й малорозчинні речовини. Кількісно розчинність виражається концентрацією насиченого розчину. Найчастіше її виражають максимальним числом грамів речовини, яку можна розчинити в 100 г розчинника за даної температури. Цю кількість речовини іноді називають коефіцієнтом розчинності, або просто розчинністю речовини. Наприклад, при 18 °С у 100 г води розчиняться 51,7 г солі нітрату плюмбуму(ІІ) Рb(NО3)2, тобто розчинність цієї солі при 18°С дорівнює 51,7. Якщо при цій самій температурі понад цю кількість додати ще солі нітрату плюмбуму(ІІ), то вона не розчиниться, а випаде у вигляді осаду.
Говорячи про розчинність речовини, слід зазначати температуру розчинення. Найчастіше розчинність твердих речовин з підвищенням темпеpатуpи зpостає. Це наочно зображується за допомогою кривих розчинності (рис. 5.2). На осі абсцис відкладають температуру, а на осі ординат – коефіцієнт розчинності. Однак розчинність деяких речовин при підвищенні температури зростає незначною мірою (наприклад NaCl, АlСl3) або навіть зменшується. На коефіцієнт розчинності твердого тіла у воді тиск впливає незначною мірою, оскільки під час розчинення не відбувається помітної зміни об’єму системи. За допомогою кривих розчинності легко обчислити, скільки солі випаде з розчину при його охолодженні. Наприклад, якщо взяти 100 г води і приготувати при 45°С насичений розчин нітрату калію, а потім охолодити його до 0°С, то, як випливає з кривої розчинності (див. рис. 5.2), має випасти 60 г кристалів солі. За кривими розчинності легко визначають коефіцієнт розчинності речовин за різних температур.
Виділення речовини з розчину при зниженні температури називається кристалізацією. Якщо в розчині містилися домішки, то внаслідок кристалізації речовина завжди добувається чистою, оскільки відносно домішок розчин залишається ненасиченим навіть при зниженні температури, і домішки не випадають в осад. На цьому базується метод очищення речовин, що називається перекристалізацією.
Під час розчинення газів у воді виділяється теплота. Тому відповідно до принципу Ле Шательє при підвищенні
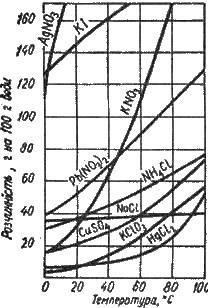
Рис. 5.2. Криві розчинності твердих речовин
Температури розчинність газів зменшується, а при зниженні – збільшується (рис. 5.3). Розчинність газів зростає при підвищенні тиску. Оскільки об’єм газу, що розчиняється в даному об’ємі води, не залежить від тиску, то розчинність газу звичайно виражають кількістю мілілітрів, що розчиняється в 100 г розчинника (див. рис. 5.3).
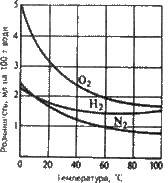
Рис. 5.3. Криві розчинності газів