Розв’язування типових задач Масова частка розчиненої речовини – РОЗЧИНИ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
§ 5.14. Розв’язування типових задач Масова частка розчиненої речовини
Задача 1. Потрібно приготувати розчин масою 320 г з масовою часткою хлориду калію 3%. Розрахуйте масу КСl і масу води, які необхідні для приготування розчину.
Розв’язання. Обчислюємо масу хлориду калію, необхідного для приготування розчину:
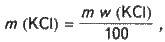
Де m – маса розчину; w (КСl) – масова частка
Калію.
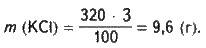
Обчислюємо масу води, необхідної для приготування розчину:
M (Н2О) = m – m(КСl); m(Н2O) = 320-9,6 = 310,4 (г).
Задача 2. Нітрат калію масою 10 г розчинили у воді об’ємом 150 мл. Густина води дорівнює 1 г /мл. Розрахуйте масову частку солі в розчині.
Розв’язання. Масу розчинника (води) визначаємо множенням його об’єму У (Н2О) на густину р(Н2О):
M(Н2О) = V (Н2O) р(Н2O);m(Н2О) = 150 ∙ 1 = 150 (г).
Обчислюємо масу добутого розчину:
M=m (Н2O)+ m (KNO3); m = 150+10=160 (г).
Розраховуємо масову частку нітрату калію в розчині:
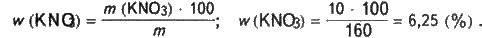
Задача 3. У воді масою 100 г при температурі
Розв’язання. Маса насиченого при температурі 25 °С розчину К3РО4, який містить 100 г води, дорівнює:
M = m (К3РО4) + m (Н2О); m = 106 + 100 = 206 (г).
Обчислюємо масову частку фосфату калію в насиченому при температурі 25 °С розчині:
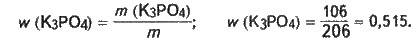
Розраховуємо масу фосфату калію, необхідного для приготування насиченого розчину масою 20 г:
M’ (К3РО4) = m’w(К3РO4); m’ (К3РО4) = 20 ∙ 0,515= 10,3 (г).
Задача 4. Кристалогідрат нітрату феруму(ІІІ) Fe(NO3)3 ∙ 9Н2O масою 60,6 г розчинили у воді масою 250 г. Визначте масову частку нітрату феруму(ІІІ) в добутому розчині.
Розв’язання. Маса добутого розчину становить:
M =m +m(Н2O); m = 60,6 + 250 = 310,6 (г).
Визначаємо кількість речовини кристалогідрату, розчиненого у воді:
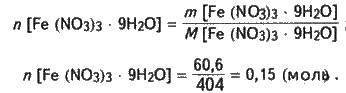
Із формули кристалогідрату випливає:
N = n ; n = 0,15 (моль).
Знаходимо масу нітрату феруму(ІІІ), що міститься в розчині:
M = n М ;
M = 0,15 ∙ 242 = 36,3 (г) .
Розраховуємо масову частку нітрату феруму(ІІІ) в розчині:
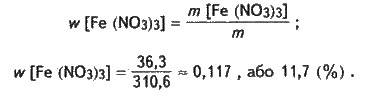
Задача 5. В лабораторії є розчин з масовою часткою гідроксиду натрію 25 %, густина якого дорівнює 1,27 г /мл. Розрахуйте його об’єм, який потрібно змішати з водою, щоб добути 500 мл розчину з масовою часткою NaOH 8 % (густина 1,09 г /моль).
Розв’язання. При розв’язуванні задачі позначимо величини, що стосуються вихідного розчину, індексом “1” (наприклад, m1 – маса вихідного розчину); величини, що стосуються розчину, який потрібно приготувати,- індексом “2” (m2 – маса розчину, який потрібно приготувати); величини, однакові для обох розчинів, індексами позначати не будемо.
Розраховуємо масу розчину NaOH, який потрібно приготувати:
M2 = V2 р2 ; m2 = 500 ∙ 1,09 = 545 (г).
Визначаємо масу чистого NaOH, який міститиметься в розчині (така сама маса гідроксиду натрію має міститися і у вихідному розчині, який буде розводитися водою):
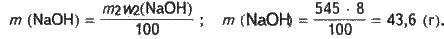
Обчислюємо масу розчину з (NaOH) = 25 %, в якому міститься гідроксид натрію масою 43,6 г:
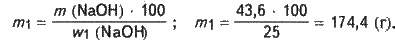
Розраховуємо об’єм вихідного розчину NaOH, який потрібно розвести водою:
V1 = m1/p1; V1 = 174,4/1,27 ≈ 137,3 (мл).
Задача 6. До розчину хлориду натрію (об’єм 120 мл, масова частка NaCl 16 %, густина 1,12 г/мл) додали воду об’ємом 80 мл (густина води 1 г/мл). Обчисліть масову частку хлориду натрію в добутому розчині.
Розв’язання. обчислюємо масу вихідного розчину m1 і масу води m(Н2O), що додали:
M1 = V1p1; m1=120 – 1,12 = 134,4 (г);
M(Н2O) = К(Н2O) р (Н2O); m(Н2O) = 80 ∙1 = 80 (г).
Розраховуємо масу добутого розчину:
M2 = m1 + m (Н2О); m2 = 134,4 + 80 = 214,4 (г).
Визначаємо масу хлориду натрію, який міститься у вихідному розчині:
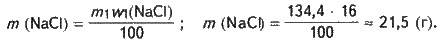
Маса NaCl у розчині після додавання води також дорівнюватиме 21,5 г.
Знаходимо масову частку хлориду натрію в добутому розчині:
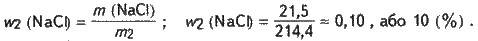
Задача 7. Сірководень об’ємом 14 мл розчинили у воді масою 500 г (нормальні умови). Обчисліть масову частку сірководню в розчині.
Розв’язання. Визначаємо кількість речовини сірководню, розчиненого у воді:
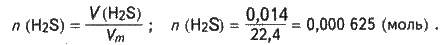
Маса розчиненого сірководню становить: m(H2S) = n(H2S)M[H2S);
M(H2S) = 0,000 625 – 34 = 0,02125 (г).
Знаходимо масу розчину:
M = m (Н2О) + m (H2S); m = 500 + 0,02125 ≈ 500,02 (г). Обчислюємо масову частку сірководню в добутому розчині:
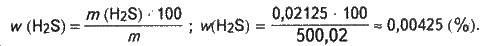
Задача 8. У склянку налили 200 мл води (густина 1 г/мл). Визначте об’єм розчину сульфату натрію (масова частка 12 %, густина 1,11 г/мл), який потрібно долити в склянку, щоб дістати розчин з масовою часткою Na2SO4 2 %.
Розв’язання. Введемо позначення: m1 – маса вихідного розчину сульфату натрію, в якому w1(Na2SO4) = 12 %. Маса Na2SO4, що міститься в цьому розчині, становить:
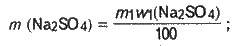
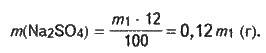
Знаходимо масу води у склянці: m(Н2O) = V(Н2O) р (Н2О); m(Н2O) = 200 -1 = 200 (г).
Обчислюємо масу розчину m2 після додавання у воду вихідного розчину сульфату натрію:
M2 = m1 + m(Н2O); m2 = (m1 + 200) (г).
Отже, в розчині, що має масу m2 = (m1 + 200) г, міститься Na2SO4 масою 0,12 m1. Масова частка Na2SO4 в цьому розчині становить:
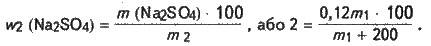
Розв’язавши це рівняння, знаходимо, що m1 = 40 г. Об’єм розчину, який потрібно додати в склянку з водою, становить: V1 = m1/p1; V1 = 40/1,11 = 36 (мл).
Молярна концентрація
Задача 1. Визначте молярну концентрацію розчину, добутого Внаслідок розчинення сульфату натрію масою 21,3 г у воді масою 150 г, якщо густина добутого розчину дорівнює 1,12 г /мл.
Розв’язання. Визначаємо масу добутого розчину:
M = m(Na2SO4) + m(Н2О); m = 21,3 + 150 = 171,3 (г).
Обчислюємо об’єм розчину:
V= m/р; V= 171,3/1,12 =153 (мл) = 0,153 (л).
Кількість речовини розчиненого сульфату натрію становить:
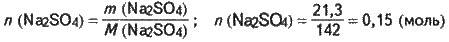
Молярна концентрація розчину с(В) – це відношення кількості розчиненої речовини В до об’єму розчину:
С (В) = n(B)/V.
Обчислюємо молярну концентрацію розчину сульфату натрію:
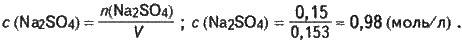
Задача 2. У лабораторії є розчин з масовою часткою сульфатної кислоти 5,5 % (густина 1,035 г/мл). Визначте об’єм цього розчину, який потрібний для приготування розчину 0,25 М H2SO4 об’ємом 300 мл.
Розв’язання. Обчислюємо кількість речовини сульфатної кислоти (100 %-го розчину), яка потрібна для приготування розчину 0,25 М H2SO4 об’ємом 0,3 л: n (H2SO4) = с (H2SO4) V; n (H2SO4) = 0,25 ∙ 0,3 = 0,075 (моль).
Маса H2SO4 становитиме: m (H2SO4) = n (H2SO4) М (H2SO4); m (H2SO4) = 0,075 – 98 = 7,35 (г).
Обчислюємо масу розчину з масовою часткою сульфатної кислоти 6,5 %, в якому міститься H2SO4 масою 7,35 г:
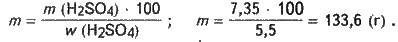
Визначаємо об’єм потрібного розчину:.
V=m/р; V= 133,6/1,035 ≈ 129,1 (мл).
Розрахунки за рівняннями реакцій, що відбуваються у розчинах
Задача 1. Яку масу розчину з масовою часткою гідроксиду натрію 4 % потрібно для повної нейтралізації хлоридної кислоти масою 30 г з масовою часткою НСl 5 %?
Розв’язання. Складаємо рівняння реакції, що відбувається в розчині:
НСl + NaOH = NaCl + Н2О.
Визначаємо масу і кількість речовини хлороводню, що міститься в розчині хлоридної кислоти:
M(НСl) = mw(НСl); m(НСl) = 30 – 0,05 = 15 (г);
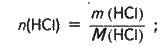
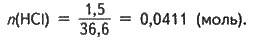
Із рівняння реакції випливає:
N(NaOH) = n(НСl); n(NaOH) = 0,0411 (моль).
0,0411 моль – кількість речовини гідроксиду натрію, яка потрібна для реакції.
Розраховуємо масу потрібного гідроксиду натрію:
M (NaOH) = n (NaOH)M (NaOH);
M(NaOH) = 0,0411 ∙ 40 = 1,644 (г).
Визначаємо необхідну масу m’ розчину гідроксиду натрію з w(NaOH) = 0,04 (4%):
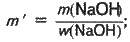
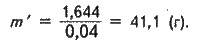
Задача 2. Який мінімальний об’єм оксиду карбону(IV) необхідно пропустити за нормальних умов через розчин масою 80 г з масовою часткою гідроксиду барію 5 %, щоб одержати гідрокарбонат барію?
Розв’язання. Записуємо рівняння реакції між гідроксидом барію і надлишком оксиду карбону(ІV):
Ва(ОН)2 + 2СО2 = Ва(НСО3)2.
Визначаємо масу гідроксиду барію, що міститься в розчині:
M = mw ;
M = 80 0,05 = 4 (г).
Кількість речовини гідроксиду барію становить:
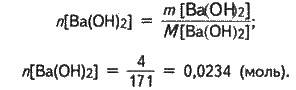
Із рівняння реакції випливає:
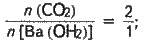
N(СO2) = 2n ;
N(СO2) = 2 – 0,0234 = 0,00468 (моль).
Визначаємо об’єм газу за нормальних умов:
V(СO2) = n(СO2) – Vm,
V(СO2) = 0,0468 – 22,4 = 1,05 (л).
Задача 3. Визначити масову частку солі, яку добуто під час змішування розчину об’ємом 40 мл з масовою часткою нітратної кислоти 0,2 і густиною 1,12 г/мл з часткою гідроксиду натрію 0,15 і густиною 1,17 г/мл.
Розв’язання. Введемо позначення:
M1 – маса; V1 – об’єм; р1 – густина розчину нітратної кислоти; m2 – маса; V2 – об’єм; р2 – густина розчину гідроксиду натрію; m3 – маса одержаного розчину. Записуємо рівняння реакції:
HNO3 + NaOH = NaNO3 + Н2О.
Визначаємо масу і кількість речовини HNO3 у розчині:
M1 = V1p1;
M1 = 40 – 1,12 = 44,8 (г);
M(НNO3) = m1w(HNO3);
M(HNO3) = 44,8 ∙ 0,2 = 8,96 (г);
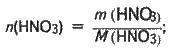
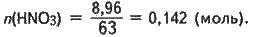
Аналогічно знаходимо масу і кількість речовини гідроксиду натрію в розчині:
M2 = V2p2;
M2 = 36 1,17 = 42,1 (г);
M(NaOH) = m1w(NaOH);
M(NaOH) = 42,1 – 0,15 = 6,32 (г);
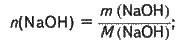
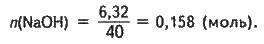
Із рівняння реакції випливає, що з нітратною кислотою кількістю речовини 0,142 моль реагуватиме гідроксид натрію кількістю речовини 0,142 моль, отже, NaOH взято з надміром.
Із рівняння реакції маємо:
N(NaOH) = n(HNO3); n (NaNO3) = 0,142 (моль).
Визначаємо масу солі, що утворилася:
M(NaNO3) = n(HNO3) M(NaNO3);
N(NaNO3) = 0,142 85 = 12,1 (г).
Маса добутого розчину становить:
M3 = m1 + m2,
M3 = 44,8 + 42,1 = 86,9 (г).
Визначаємо масову частку солі в добутому розчині:
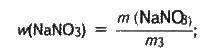
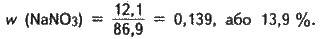
Реакції обміну в розчинах електролітів
Задача 1. Реакція відбувається за рівнянням ЗВа2+ + 2РО3-4 = Ва3(РO4)2 ↓.
Напишіть два різних рівняння у молекулярній формі, що відповідають цим реакціям.
Розв’язання. До іонів у лівій частині вихідного рівняння допишемо іони з протилежним знаком заряду з таким коефіцієнтом, щоб можна було скласти формули речовин. При цьому враховуємо, що вихідні речовини повинні бути досить добре розчинними у воді. Потім ті самі іони з такими самими коефіцієнтами записуємо і в правій частині рівняння:
ЗВа2+ + 2РО3-4 = Ва3(РO4)2 ↓;
6Сl – + 6Н+ = 6Сl – + 6Н+.
Об’єднуючи іони обох рівнянь в молекули, дістанемо рівняння реакції в молекулярній формі:
ЗВаСl2 + 2Н3РO4 = Ва3(РO4)2 і + 6НСl.
Аналогічно добираємо й інші іони, що підходять:
3Ba2+ + 2РO3-4= Ва3(РO4)2 ↓;
6NO-3 + 6Na+ = 6NO-3 + 6Na+.
Дістаємо друге рівняння в молекулярній формі:
ЗВа(NО3)2 + 2N3РO4 = Ва3(РO4)2 ↓ + 6NaNO3.
Задача 2. Напишіть у молекулярній та іонній формах рівняння реакцій між хлоридом алюмінію і нітратом аргентуму. Наведіть приклад іншої реакції, суть якої виражається таким самим рівнянням, що і першої.
Розв’язання. Складаємо рівняння реакції в молекулярній формі:
АlСl3 + ЗАgМО3 = ЗАgСl↓ + Аl(NО3)3.
Зобразивши речовини, що добре дисоціюють, у вигляді іонів, одержимо іонне рівняння реакції:
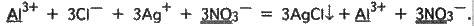
Виключаємо з обох частин рівності однакові іони, тобто іони, що не беруть участі в реакції (їх підкреслено). Записуємо скорочене іонне рівняння реакції:
3Ag+ + ЗСl – = 3АgСl↓ або Аg+ + Сl – = АgОl.
З погляду теорії електролітичної дисоціації суть реакції, що відбиває скорочене іонне рівняння, зводиться до взаємодії іонів аргентуму з хлорид-іонами. Решта іонів участі в реакції не беруть.
Приклад іншої реакції, що виражається таким самим рівнянням у скороченій іонній формі:
Аg+ + Сl – = АgСl↓;
NO3- + Н+ = NO3- + Н+.
Рівняння в молекулярній формі:
АglNО3 + НСl = АgСl↓ + HNO3.
Водневий показник
Задача 1. Приймаючи, що сульфатна кислота дисоціює повністю, визначте pH її 0,012М розчину.
Розв’язання. Запишемо рівняння повної дисоціації сульфатної кислоти на іони:
H2SO4 ⇆ 2Н+ + SO42-.
Як бачимо, з 1 моль кислоти утворюється 2 моль Н+. Відповідно з 0,012 моль кислоти утворюється 0,024 моль Н+. Концентрація іонів гідрогену в розчині дорівнюватиме 0,025 моль/л. Звідси:
PH = – lg ; pH = – lg 0,024 = 1,62.
Задача 2. Визначте pH 0,005 М розчину гідроксиду натрію.
Розв’язання. У розчині сильний електроліт – гідроксид натрію – повністю дисоціює на іони:
NaOH ⇆Na+ + ОН-.
З 1 моль NaOH утворюється 1 моль ОН-, а з 0,005 моль NaOH – 0,005 моль ОН-. Отже, концентрація іонів ОН – дорівнює 0,005 моль/л.
Знаючи величину іонного добутку води = 10-14, знаходимо концентрацію іонів гідрогену:
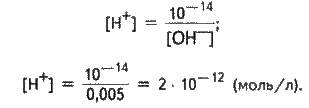
Одержуємо
PH = – lg ; pH = – lg = 11,7.
Задача 3. Водневий показник розчину хлоридної кислоти дорівнює 2,1. Визначте концентрацію хлоридної кислоти в розчині.
Розв’язання. Позначимо концентрацію іонів гідрогену в розчині х. Тоді – lgх = 2,1 або lgх = -2,1. Перетворимо логарифм таким чином, щоб його характеристика була від’ємною, а мантиса – додатною (віднімемо 1 і додамо 1):
РН = – 2,1 = (-2 -1) + (-0,1 + 1) = – 3 + 0,9 – 3 = lg 10-3 , 0,9 = lg8.
Звідси lgx = lg8 + lg 10-3 = lg (8 ∙ 10-3), тобто = 8 ∙ 10-3 = 0,008 (моль/л).
У розчині сильна хлоридна кислота повністю дисоціює на іони:
НСl ⇆Н+ + Сl-.
1 моль іонів Н+ утворюється з 1 моль НСl, а 0,008 моль іонів Н+ утворюються з 0,008 моль НСl. Отже, концентрація хлоридної кислоти в розчині становить 0,008 моль/л.