Сірководень і сульфіди – ПІДГРУПА ОКСИГЕНУ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 9. ПІДГРУПА ОКСИГЕНУ
§ 9.4. Сірководень і сульфіди
Сірководень H2S – безбарвний газ із запахом тухлих яєць. Він добре розчинний у воді (при 20°С в 1 об’ємі води розчиняється 2,5 об’єму сірководню).
Поширення в природі. Сірководень трапляється в природі у вулканічних газах і у водах деяких мінеральних джерел, наприклад П’ятигорська, Мацести. Він утворюється під час гниття сірковмісних органічних речовин різних рослинних і
Добування. Сірководень може бути добутий безпосереднім сполученням сірки з воднем при нагріванні:
Проте звичайно його добувають дією розведеної хлоридної або сульфатної кислот на сульфід феруму(ІІ):
2НСl + FeS = FeCl2 + H2S.
Цю реакцію часто проводять в апараті Кіппа.
Фізичні властивості. Сірководень – дуже отруйний газ, що уражає нервову систему. Тому працювати з ним потрібно у витяжній шафі або з приладами, що герметично закриваються. Допустимий вміст H2S у промислових приміщеннях становить 0,01 мг
Розчин сірководню у воді називається сірководневою водою, або сульфідною кислотою (вона виявляє властивості слабкої кислоти).
Хімічні властивості. H2S – менш міцна сполука, ніж вода. Це зумовлено більшим розміром атома сульфуру порівняно з атомом оксигену (див. п. 6, табл. 9.1). Тому зв’язок Н-О коротший і міцніший, ніж зв’язок Н-S. При сильному нагріванні сірководень майже повністю розкладається на сірку і водень:
H2S = S + Н2.
Газуватий H2S горить на повітрі блакитним полум’ям з утворенням оксиду сульфуру(ІV) і води:
2H2S + 3О2 = 2SO2 + 2Н2О.
При недостатній кількості кисню утворюються сірка і вода:
2H2S + О2 = 2S + 2Н2O.
Цю реакцію використовують для добування сірки із сірководню в промисловому масштабі.
Сірководень – досить сильний відновник. Цю його важливу хімічну властивість можна пояснити так. У розчині H2S порівняно легко віддає електрони молекулам кисню повітря:
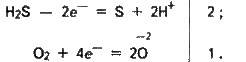
У цьому випадку H2S окиснюється киснем повітря до сірки, яка робить сірководневу воду каламутною. Сумарне рівняння реакції:
2H2S + О2 = 2S ↓ + 2Н2О.
Цим пояснюється і той факт, що сірководень не нагромаджується в дуже великих кількостях у природі під час гниття органічних речовин – кисень повітря окиснює його до вільної сірки.
Енергійно реагує сірководень з розчинами галогенів. Наприклад:
H2S + l2 = 2Нl + S.
Відбувається виділення сірки і знебарвлення розчину йоду.
Слабка сульфідна кислота дисоціює на іони Н+ і HS – :
H2S ⇆ Н+ + HS-;
HS – ⇆ Н+ + S2-.
В її розчині сульфід-іони S2- містяться в дуже малих кількостях.
Сульфіди. Сульфідна кислота, як двохосновна, утворює два ряди солей – середні (сульфіди) і кислі (гідросульфіди). Наприклад, Na2S – сульфід натрію, NaHS – гідросульфід натрію.
Майже всі гідросульфіди добре розчиняються у воді. Сульфіди лужних і лужноземельних металів також розчинні у воді, а решта металів практично нерозчинні або малорозчинні; деякі з них не розчиняються і в розведених розчинах кислот. Тому такі сульфіди можна легко добути, пропускаючи сірководень крізь розчин солі відповідного металу, наприклад:
CuSO4 + H2S = CuS ↓ + H2SO4
Або
Cu2+ + H2S = CuS ↓ + 2Н+.
Деякі сульфіди мають характерне забарвлення : CuS і PbS – чорне, CdS – жовте, ZnS – біле, MnS – рожеве, SnS – коричневе, Sb2S3 – оранжеве тощо. На різній розчинності сульфідів і різному забарвленні багатьох з них базується якісний аналіз катіонів.