СПЕКТРОСКОП. СПЕКТРАЛЬНИЙ АНАЛІЗ
АТОМНА І ЯДЕРНА ФІЗИКА
Розділ 5 Атомна і ядерна фізика
§ 46. СПЕКТРОСКОП. СПЕКТРАЛЬНИЙ АНАЛІЗ
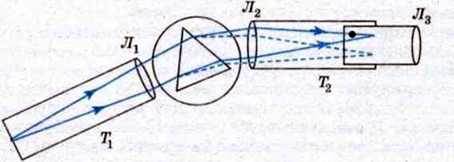
Явище дисперсії світла покладено в основу пристрою призматичних спектральних приладів: спектроскопів і спектрографів. Схема призматичного спектроскопа показана на мал. 192. Він складається з труби коліматора T1, трикутної призми і зорової труби Т2. Досліджуване світло, пройшовши через щілину і лінзу Л1 труби коліматора, падає на призму, в якій відбувається спектральне розкладання світла. Лінза Л2 зорової труби Т2 дає зображення спектра, яке
Поставимо перед щілиною спектроскопа електричну лампу розжарення і за допомогою спектроскопа вивчатимемо випромінюване нею світло. При незначній силі струму нитка лампи має червоний колір. У цей момент спектр випромінюваного нею світла є смужкою червоного кольору. Поступово збільшуючи силу струму, який тече через нитку лампи, зазначаємо, що в спектрі її світла з’являться спочатку оранжева, потім по черзі жовта,
Під час фотографування спектра за допомогою спеціальних фотоапаратів на фотоплівках було виявлено, що перед областю червоного світла і за областю фіолетового світла є невидимі області спектра, що отримали відповідно назву інфрачервоної і ультрафіолетової областей.
Вивчення цих не сприйманих оком областей спектра показало, що у
Мал. 192

Мал. 193

Мал. 194

Мал. 195
Ультрафіолетовій області відповідають довжини хвиль у діапазоні від 1 до 380 нм, а інфрачервоній області – довжини хвиль у діапазоні від 760 нм до 1 мм.
Враховуючи, що видима частина спектра лежить в межах від 380 до 760 нм, доходимо висновку, що для світла, яке випромінюється сильно нагрітим тілом, довжини хвиль лежать в інтервалі від 1 нм до 1 мм. Істотно, що в цьому інтервалі немає незайнятих проміжків, тобто спектр цього випромінювання є суцільним.
Помістимо перед щілиною спектроскопа трубку, наповнену воднем при низькому тиску (мал. 194). Під час під’єднання трубки до джерела високої напруги в ній відбувається електричний розряд і з трубки випромінюється червонувате світло. Спектр цього світла складається з декількох світлих ліній на темному фоні (мал. 193, 7). Такий спектр отримав назву лінійчастого спектра випромінювання.
Поставивши між щілиною спектроскопа і лампою розжарення трубку, заповнену воднем (мал. 195), на тлі суцільного спектра випускання нитки лампи розжарення ми виявимо в червоній його частині декілька темних (чорних) ліній (мал. 193,4). Такі спектри отримали назву лінійчастих спектрів поглинання, а самі темні лінії – ліній поглинання. Спектри поглинання вперше спостерігав Г. Кірхгоф.
Лінійчасті спектри утворюються, якщо світло випускається або поглинається речовиною в газоподібному атомарному стані. Положення темних ліній у спектрі поглинання речовини при даній температурі точно збігаються з положеннями світлих ліній у спектрі випускання цієї ж речовини при тій же температурі. Інакше кажучи, речовина в атомарному газоподібному стані при даній температурі випускає і поглинає хвилі однакових частот (правило Кірхгофа).
Існують ще смугасті спектри, які складаються з окремих смуг, розділених темними проміжками. За допомогою дуже досконалого спектрального апарата можна виявити, що кожна смуга – це сукупність великої кількості
Мал. 196
Щільно розміщених ліній. На відміну від лінійчастих спектрів, смугасті спектри утворюються не атомами, а молекулами, що слабо зв’язані або не зв’язані між собою.
Склад речовини може бути визначений за спектром випускання (емісійний метод) або за спектром поглинання (метод абсорбції).
Якщо в затемненому приміщенні перед щілиною спектроскопа поставити спиртівку, що горить, то побачимо суцільний спектр дуже малої яскравості. Джерелом світла, що зумовлює цей суцільний спектр, є розжарені тверді частинки в полум’ї.
Внесемо у полум’я спиртівки крупинку кухонної солі (NaCl). Зазначимо, що полум’я забарвиться в інтенсивний жовтий колір, а в його спектрі з’являться дві дуже близько розташовані яскраві жовті лінії, що знаходяться в жовтій частині спектра (мал. 196). Те саме можна спостерігати, якщо замість кухонної солі внести до полум’я спиртівки крупинку глауберової солі (Na2SО4), йодиду натрію (Nal), сульфіду натрію (Na2S) або карбонату натрію (Na2CО3). Будь-яка сіль натрію, будучи введена в полум’я спиртівки, забарвлює його в жовтий колір, в жовтій частині спектра з’являються дві яскраві, близько розташовані жовті лінії. Іншими словами, характерною межею натрію є те, що його розжарені пари дають спектр, в якому завжди присутні дві яскраві лінії в жовтій частині спектра.
Якщо через пари натрію, які знаходяться в скляній трубці, пропустити електричний струм, то ці пари світитимуться жовтим кольором. У спектрі цього випромінювання також будуть присутні вказані вище дві жовті лінії.
У 1860 р. німецькі учені Г. Кірхгоф і Р. Бунзен, вивчаючи спектри металів, встановили, що кожен метал у пароподібному стані має свій характерний лінійчастий спектр. Введення у полум’я пальника будь-якої солі одного і того ж металу завжди приводить до появи однакового лінійчастого спектра випускання.
Окремі лінії у спектрах різних елементів можуть випадково збігатися, але в цілому спектр кожного елемента є його постійною і строго індивідуальною характеристикою.
Разом з тим виявилось, що при внесенні до полум’я суміші солей різних металів у спектрі одночасно з’являються всі характерні для цих металів лінії. Яскравість спектральних ліній залежить від концентрації елемента в даній суміші речовин.
Так був відкритий новий метод визначення хімічного складу речовини – спектральний аналіз.
Спектральним аналізом називають метод визначення хімічного складу складних речовин, заснований на вивченні лінійчастих спектрів цих речовин.
Виявлення в спектрі досліджуваного зразка нових, незнайомих ліній означало, що у зразку присутні домішки невідомих у той час елементів. За допомогою спектрального аналізу були відкриті спочатку Рубідій і Цезій,

Мал. 197
А потім Талій, Індій, Галій. Усього методом спектрального аналізу було відкрито 24 хімічних елементи.
Якщо сфотографувати спектр сонячного світла, отриманий за допомогою якісного спектроскопа, то на знімку будуть спостерігатися чіткі лінії поглинання (мал. 197). Вперше ці лінії описав німецький фізик Й. Фраунгофер, і тому вони отримали назву – лінії Фраунгофера. Поява цих ліній пов’язана з проходженням сонячного світла через атмосферу Сонця і частково з проходженням через атмосферу Землі. Таким чином, спектр сонячного світла – спектр поглинання.
Зіставляючи лінії Фраунгофера з лініями випускання різних елементів, можна встановити, які елементи входять до складу атмосфери Сонця. Зокрема, цим методом був вперше виявлений в атмосфері Сонця елемент Гелій. Пізніше Гелій виявили і на Землі.
Спектральний аналіз за спектрами поглинання використовують при вивченні хімічного складу речовин. Для проведення спектрального аналізу абсорбції досліджувану речовину спалюють в полум’ї, світло від якого прямує в спектроскоп або спектрограф. Одночасно через полум’я пропускають світло від еталонної спектральної трубки. Якщо в спектрі з’являться лінії поглинання, то це свідчить про речовину, що міститься в спектральній трубці досліджуваної речовини.
Спектральний аналіз має наступні переваги над хімічним аналізом: висока чутливість, швидкість, простота визначення і невелика маса речовини, необхідної для його проведення.
Чутливість спектрального аналізу дуже висока: з його допомогою можна виявити елемент, домішка якого в речовині становить всього одну мільйонну частку відсотка. За сприятливих умов вдається виявити речовину, яка міститься в пробі масою 10-6 г.
Швидкість спектрального аналізу значно більша за швидкість хімічного аналізу. Тому спектральний аналіз застосовують як експрес-аналіз у металургії, в криміналістиці. Для проведення спектрального аналізу потрібно декілька десятків мікрограмів речовини. Величезне значення спектрального аналізу полягає в тому, що його можна провести, не вступаючи в безпосередній контакт з досліджуваною речовиною: в спектральному аналізі досить проаналізувати світло, яке досліджувана речовина випускає або поглинає.
Це цікаво знати
Розвиток вчення про спектральний аналіз. Кольори спектра, отримані при пропусканні пучка сонячних променів крізь призму, не чисті. Окремі кольори накладаються один на одного і одержуються змішані кольори. Ще І. Ньютон наголошував про необхідність отримання чистого спектра, в якому б кольори не накладалися один на одного. Саме у чистому спектрі добре видно, чи існують всі переходи кольорів від червоного до фіолетового, або деякі із кольорів відсутні.
У 1802 р. англійський фізик В. Вульстен (1766-1828) опублікував працю про заломлювальну та розсіювальну здатності різних тіл. У цій праці вчений повідомляв, що сонячний спектр не являє собою неперервний ряд усіх кольорів від червоного до фіолетового, а перерізається безліччю темних ліній. Те саме вчений спостерігав у спектрах, які давали різні розжарені тіла. І тут спектр не був неперервним, а складався зі світлих смуг з темними проміжками. Проте Вульстен не зумів пояснити походження цих темних ліній.
Дане явище більш детально було вивчено І. Фраунгофером. Учений у своїх дослідах пропускав сонячне світло через вузьку щілину в темній кімнаті. Пучок світла попадав на призму, і, виходячи з неї, поступав до зорової труби. Із об’єктива труби у полі зору з’являвся чистий спектр, який розглядали за допомогою окуляра як збільшувального скла. Фраунгофер відтворив малюнок збільшеного спектра, який він спостерігав у зорову трубу. Наявність темних ліній у сонячному спектрі, очевидно, свідчила про відсутність у ньому певних кольорових променів. Дійсно, коли б у спектрі були всі переходи кольорів від крайнього фіолетового до крайнього червоного, то спектр мав би бути неперервний (суцільний).
До появи робіт Кірхгофа і Бунзена не було достатньо обгрунтовано той факт, що спектральні лінії можуть характеризувати розжарену у полум’ї речовину. У доведенні цього факту вченим допоміг сконструйований ними спектроскоп.
Перший спектроскоп Кірхгофа і Бунзена мав конструкцію, показану на мал. 198: F – скляна призма, трубка В на одному кінці, оберненому до полум’я, мала щілину, а на другому – збиральну лінзу, яка робила паралельними промені, що йшли від щілини. Ці промені заломлювалися призмою і отримуваний спектр розглядався зоровою трубою С з 8-кратним збільшенням.
За допомогою спектроскопа Кірхгоф і Бунзен дослідили багато речовин, особливо

Мал. 198

Мал. 199
Металів. Досліджувану речовину закріпляли на платиновій дротині і нагрівали у полум’ї бунзенової спиртівки. При високій температурі речовина перетворювалася на пару, і світло цієї розігрітої пари досліджували. Ці спостереження привели до відкриття двох нових елементів: Цезія та Рубідія. Пізніше за допомогою спектроскопа було відкрито декілька інших елементів, а саме Талій, Галій, Індій, Гелій.
Професор Штейнгель із Мюнхена удосконалив спектроскоп Кірхгофа, надавши йому форми, зображеної на мал. 199.
Пуста призма була замінена на масивну скляну, а крім коліматора та зорової труби з’явилася ще третя труба. Ця труба на кінці, оберненому до призми, має збиральну лінзу, а на другому кінці закрита скляною пластинкою із дрібними поділками. Промені, що виходять із цієї труби, падають на поверхню призми і відбиваються у зорову трубу так, що спостерігач бачить у полі зору, вище або нижче спектра, поділки, за допомогою яких може точно визначити положення спектральних ліній.
Секрет Страдіварі. Таємниця скрипок Страдіварі розгадана! Шведські хіміки стверджують, що інструменти мали таке гарне звучання тому, що майстер покривав їх особливим лаком. Склад цього лаку вдалося визначити за допомогою декількох видів аналізу, в тому числі і спектрографічного. Маленький шматочок лаку 200-літньої давності вдалося розкласти на основні компоненти. Потім із таких самих хімічних сполук отримали свіжий лак і покрили ним сучасні скрипки. Музичні експерти не змогли відрізнити їх за звучанням від давніх інструментів.