СПОЛУКИ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ З ГІДРОГЕНОМ. СОЛІ АМОНІЮ
ТЕМА 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ
УРОК 5. СПОЛУКИ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ З ГІДРОГЕНОМ. СОЛІ АМОНІЮ
Цілі: формувати знання про склад сполук неметалічних елементів з Гідрогеном, властивості та добування амоніаку і хлороводню, будову солей амонію, якісні реакції на іони амонію та хлорид-іони; формувати вміння складати формули сполук і рівняння реакцій, що характеризують властивості та способи добування сполук неметалічних елементів з Гідрогеном.
Обладнання: роздавальний матеріал, мультимедійний проектор, комп’ютер.
Тип
Форми роботи: евристична лекція, робота в групах, демонстраційний експеримент, прийом “Незакінчені речення”.
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань
Прийом “Незакінчені речення”
1. В атома Сульфуру на зовнішньому рівні міститься…
2. Явище існування хімічного елемента у вигляді кількох простих речовин, різних за властивостями й будовою, називається.
3. Алотропні модифікації Карбону – це.
4. Озоновий шар від поверхні Землі розміщується на відстані.
5. Унаслідок руйнування озонового
6. У вільному стані Нітроген трапляється у вигляді.
7. Кристалічна речовина, жирна на дотик, сірого або чорного кольору, з металічним блиском, шаруватої структури – це.
8. Другим елементом за поширенням у природі після Оксигену є.
9. Поглинання газів, пари та розчинених речовин поверхневим шаром інших речовин називається.
10. Основною складовою частиною повітря є.
III. Мотивація навчальної діяльності. Оголошення теми й мети уроку
IV. Вивчення нового матеріалу
Пригадується матеріал про леткі сполуки неметалів з Гідрогеном. Валентність неметалу в цих сполуках для елементів IV – VII груп дорівнює “8 – № групи”.
IV група CH4, SiH4
V група NH3, PH3
VI група H2S, H2O
VII група HCl, HF, HBr
Робота в групах
Учні об’єднуються в парне число груп. Одна частина класу опрацьовує матеріал про гідроген хлорид, інша – про амоніак. На допомогу учням даються підручники та довідники.
Представник однієї з груп дає характеристику гідроген хлориду, його складу і властивостям, інші групи допомагають і доповнюють. Під час розчинення гідроген хлориду у воді утворюється хлоридна кислота, яка проявляє всі загальні властивості кислот. Хлоридна кислота утворює середні солі – хлориди.
Демонстраційний дослід. Якісна реакція на хлорид-іон
(Можна використати ЕЗНП “Віртуальна хімічна лабораторія”.) Представник іншої групи дає характеристику амоніаку, описує його склад і властивості. Інші групи допомагають і доповнюють.
Демонстраційний дослід. Добування амоніаку й розчинення його у воді (“фонтан”), випробовування розчину фенолфталеїном
(Можна використати ЕЗНП “Віртуальна хімічна лабораторія”.)
Хімічні властивості амоніаку
1. Горіння амоніаку:
4NH3 + 3O2 = 2N2 + 6H2O
2. Каталітичне окиснення амоніаку:
4NH3 + 5O2 = 4NO + 6H2O
3. Взаємодія амоніаку з кислотами:
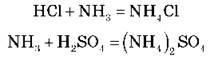
Демонстраційний дослід. Утворення амоній хлориду з амоніаку і хлороводню
(Можна використати ЕЗНП “Віртуальна хімічна лабораторія”.) Учитель пояснює донорно-акцепторний механізм утворення зв’язку на прикладі іона амонію.
Демонстраційний дослід. Якісна реакція на іон амонію
(Можна використати ЕЗНП “Віртуальна хімічна лабораторія”.) Дається інформація про солі амонію, наводяться приклади солей. Стисло характеризуються їх властивості.
Демонстраційний дослід. Ознайомлення зі зразками солей амонію
(Можна використати ЕЗНП “Віртуальна хімічна лабораторія”.)
V. Первинна перевірка засвоєння знань
1. Вам видано дві пробірки без підписів, в одній з яких знаходиться розчин амоніаку, а в іншій – розчин гідроген хлориду. Як з допомогою одного реактиву виявити, що в якій пробірці знаходиться?
2. Вам видано дві пробірки без підписів, в одній з яких знаходиться розчин амоній нітрату, а в іншій – натрій хлорид. З допомогою яких реакцій можна виявити, що в якій пробірці знаходиться?
VI. Підбиття підсумків уроку
VІІ. Домашнє завдання