Стаціонарна дифузія. Коефіцієнт дифузії газів
ФІЗИКА
Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
Розділ 5 ЯВИЩА ПЕРЕНЕСЕННЯ
5.5. Стаціонарна дифузія. Коефіцієнт дифузії газів
Молекулярно-кінетична теорія дає змогу кількісно оцінити коефіцієнт дифузії і виразити його через молекулярні величини – довжину вільного пробігу молекул і швидкість теплового руху їх.
Розглянемо площадку s у посудині з газовою сумішшю, перпендикулярну до осі х (рис. 5.4), уздовж якої підтримується стала різниця концентрацій Δn = n1 – n2, тобто розглянемо стаціонарний процес. Візьмемо для визначеності,
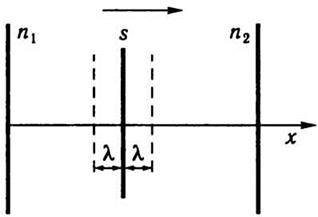
Рис. 5.4
Як визначити число молекул, які перетинають 1 см2 площадки? Молекули мають різні швидкості, але для грубої оцінки візьмемо, що швидкості всіх молекул однакові
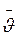 . Вважатимемо, що теплові швидкості молекул рівномірно розподіляються у трьох взаємно перпендикулярних напрямах. Тоді з усіх молекул в одиниці об’єму 1/3 частина їх рухається вздовж осі х, половина з яких рухається в позитивному напрямі осі х, а друга половина – в протилежному напрямі.
. Вважатимемо, що теплові швидкості молекул рівномірно розподіляються у трьох взаємно перпендикулярних напрямах. Тоді з усіх молекул в одиниці об’єму 1/3 частина їх рухається вздовж осі х, половина з яких рухається в позитивному напрямі осі х, а друга половина – в протилежному напрямі.Отже, число молекул N1, які перетинають 1 см2 площадки за 1 с зліва направо, і число молекул N2, які перетинають ту саму площадку в протилежному напрямі, дорівнюють:
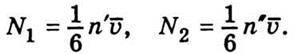
Тут n’ і n” – концентрації молекул з одного і другого боків від площадки, які змінюються вздовж осі х внаслідок зіткнень молекул між собою. Вважатимемо, що n’ і n” – це ті числа молекул в одиниці об’єму, які були на відстані 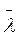 , (середня довжина вільного пробігу) з обох боків від площадки.
, (середня довжина вільного пробігу) з обох боків від площадки.
Тоді дифузійний потік N визначаємо так:
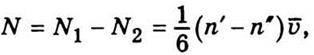
Де n’ – n” – різниця концентрацій молекул між точками, віддаленими одна від одної відстанню 2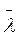 . Оскільки
. Оскільки 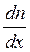 є різницею концентрацій, що припадає на одиницю довжини, то на відстані 2λ вона дорівнює
є різницею концентрацій, що припадає на одиницю довжини, то на відстані 2λ вона дорівнює
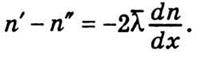
Ця формула справедлива, якщо значення 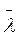 досить мале.
досить мале.
Отже, для дифузійного потоку дістанемо такий вираз:
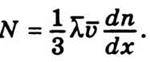
Якщо помножити ліву і праву частини цієї рівності на масу молекули m, то одержимо
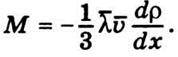
Порівнюючи це рівняння з рівняннями (5.11) і (5.12) закону Фіка
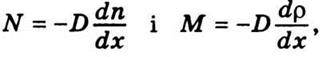
Знаходимо вираз для визначення коефіцієнта дифузії:

Із цього виразу видно, що коефіцієнт дифузії обернено пропорційний тиску газу, оскільки 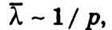 і прямо пропорційний квадратному кореню із температури, адже
і прямо пропорційний квадратному кореню із температури, адже 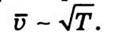
Під час виведення формули (5.18) не бралася до уваги дифузія другої компоненти, яка також відбувається. Вона не може не впливати на дифузію заданої компоненти.
Явище дифузії, яке ми щойно розглянули, виникає тоді, коли в газі існує різниця (градієнт) концентрації будь-якої компоненти. Процес дифузії при цьому приводить до зникнення градієнта і перетворює неоднорідну газову суміш в однорідну.
Крім такої “концентраційної” дифузії існує також дифузія, що називається термічною дифузією (термодифузією), яка приводить до протилежного результату – до часткового розділення однорідної газової суміші й перетворення її в неоднорідну. Це явище теоретично передбачено 1911 р., а експериментально виявлено 1917 р. Явище термодифузії полягає в тому, що різниця температур в однорідній газовій суміші спричинює виникнення різниці концентрацій компонент суміші в напрямі зменшення температури.
Існує ще один вид дифузії, який називається барочною дифузією (бародифузією). Вона виникає в газовій суміші під дією різниці тисків. Бародифузія також передбачає розділення газових сумішей. Цей метод, проте, не знайшов практичного застосування.