Стан рівноваги – Константа рівноваги – Характеристики хімічної рівноваги
ХІМІЧНА РІВНОВАГА
1. Характеристики хімічної рівноваги
1.2 . Константа рівноваги
У ході реакції рівноваги первинна концентрація початкових речовин постійно зменшується. Внаслідок цього знижується і швидкість прямої реакції.
Одночасно постійно підвищується концентрація продуктів реакції. Внаслідок цього підвищується швидкість зворотної реакції.
Для бімолекулярної реакції типу 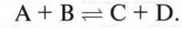 можна скласти наступні вирази швидкості прямої та зворотної реакції:
можна скласти наступні вирази швидкості прямої та зворотної реакції:
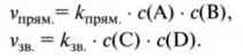
Коли швидкості
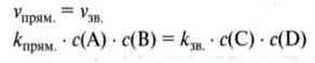
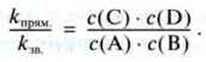
Відношення kпрям./kзв. замінює нова константа. Звідси:
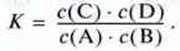
Цю константу К називають константою рівноваги. Для будь-якої реакції типу
АА + bВ +…  rR + sS +…
rR + sS +…
Константу записують на основі закону діючих мас.
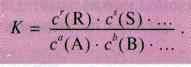
Стан рівноваги
Стан рівноваги – і, відповідно, константа рівноваги – визначається температурою, за якої відбувається
– Якщо константа рівноваги дуже велиш, то рівновага практично повністю зміщена в бік утворення продуктів реакції.
– Якщо константа рівноваги дуже мала, то рівновага практично повністю зміщена в бік початкових речовин.
Запам’ятайте: власне, більшість хімічних реакцій – реакції рівноваги.
Приклад. При згоранні водню практично на 100 % утворюється водяна пара, оскільки константа рівноваги для реакції 2H2 + O2  2 Н2O при 25 °С має значення
2 Н2O при 25 °С має значення
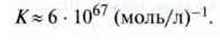
Related posts:
- СТАН ХІМІЧНОЇ РІВНОВАГИ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА РІВНОВАГА СТАН ХІМІЧНОЇ РІВНОВАГИ Умова здійснення хімічної рівноваги: ΔH = ТΔS. За умови хімічної рівноваги швидкість прямої реакції дорівнює швидкості зворотної реакції. Стан рівноваги характеризує константа рівноваги К. Для системи За значенням константи рівноваги можна робити висновки про глибину протікання реакції: Перша реакція порівняно з другою протікає практично […]...
- Визначення констант рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги 1.3. Визначення констант рівноваги Знаючи концентрації речовин, що знаходяться в стані рівноваги, можна обчислити відповідну константу рівноваги. Приклад. Початкова кількість речовини n0 = 1 моль гідроген йодиду в реакції з утворенням водню і йоду при температурі Т = 446 °С розпалася n = 0,22 моль (н. у.). Відповідно до […]...
- Реакції рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги Багато хімічних реакцій оборотні. В якому напрямі вони проходитимуть залежить від наявних умов, наприклад, від температури. 1.1. Реакції рівноваги В оборотних реакціях за певних і постійних умов можуть проходити як пряма, так і зворотна реакції. Приклад. Суміш газоподібного йоду і водню реагує при підвищеній температурі, утворюючи гідроген йодид. Н2 […]...
- ЗМІЩЕННЯ ХІМІЧНОЇ РІВНОВАГИ. ПРИНЦИП ЛЕ ШАТЕЛЬЄ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА РІВНОВАГА ЗМІЩЕННЯ ХІМІЧНОЇ РІВНОВАГИ. ПРИНЦИП ЛЕ ШАТЕЛЬЄ Якщо система, що знаходиться в рівновазі, піддається зовнішньому впливу, рівновага зміщується у напрямку послаблення цього впливу. Відповідно до принципу Ле Шательє під час нагрівання рівновага зміщується у бік ендотермічної реакції; при підвищенні тиску – у бік реакції, яка проходить зі зменшенням […]...
- Зміна концентрації – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.3 . Зміна концентрації У випадку зміни концентрації однієї речовини в зрівноваженій системі змінюються концентрації всіх інших речовин. Раніше наголошувалося, що стан рівноваги залежить від температури та тиску, зміна концентрації речовин викличе зміщення рівноваги і система намагатиметься відновити стан рівноваги. В реакції рівноваги А […]...
- Зміна тиску – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.2 . Зміна тиску Реакції рівноваги, в яких беруть участь гази, часто супроводжуються зміною кількості частинок. Приклад. При синтезі амоніаку з простих речовин реагують між собою 3 моль водню і 1 моль азоту та утворюється 2 моль амоніаку: 3Н2 + N2 2NH3. Кількість частинок […]...
- Принцип зміщення рівноваги – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.4 . Принцип зміщення рівноваги Усі чинники, що впливають на хімічну рівновагу, можна об’єднати таким чином: Увага: зміна тиску впливає на рівновагу лише в замкнутій системі. Поведінка системи, яка знаходиться в хімічній рівновазі по відношенню до зовнішніх впливів тиску і температури, визначається спільним принципом: […]...
- Константа дисоціації – Електролітична дисоціація ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.6. Електролітична дисоціація 6.6.4. Константа дисоціації Як уже згадувалось, дисоціація – процес оборотний: паралельно з розщепленням молекул на йони відбуваються процеси сполучення йонів у молекули – асоціація. Під час дисоціації слабких електролітів, наприклад нітритної кислоти, у певний момент встановлюється […]...
- Слабкі кислоти й основи – Сила кислот і основ – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.3. Сила кислот і основ Слабкі кислоти й основи У слабких кислот і основ дисоціація є неповною. Внаслідок цього в розчині є недисоційовані молекули. Тому показник pH неможливо розрахувати лише з концентрації кислоти або основи. Додатково потрібна інформація про стан протолітичної рівноваги: Оскільки в цьому випадку концентрація молекул води […]...
- ІОНІЗАЦІЯ ВОДИ. ІОННИЙ ДОБУТОК ВОДИ. КОНСТАНТА ІОНІЗАЦІЇ ВОДИ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА РІВНОВАГА ІОНІЗАЦІЯ ВОДИ. ІОННИЙ ДОБУТОК ВОДИ. КОНСТАНТА ІОНІЗАЦІЇ ВОДИ Іонний добуток води: Водневий показник Нейтральне середовище: Кисле середовище: Лужне середовище: Нижче наведена шкала взаємозв’язку pH і...
- Швидкість хімічної реакції – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач І. Швидкість хімічної реакції Формули і поняття, які використовуються: Де v1 – швидкість прямої реакції, V2 – швидкість зворотної реакції, A, Б – реагенти реакції, B, Г – продукти реакції, С(А), с(Б) – концентрації реагентів, С(В), […]...
- Хімічна рівновага – Хімічні реакції Хімія Загальна хімія Хімічні реакції Хімічна рівновага Хімічні реакції, які за одних і тих самих умов можуть іти в протилежних напрямах, називаються оборотнимИ. У випадку, якщо за даних умов реагенти повністю перетворюються на продукти реакції, реакції називаються НеоборотнимИ. Умови необоротності хімічних реакцій 1) Продукти, що утворюються, виводяться зі сфери реакції – випадають у вигляді осаду, […]...
- Види рівноваги – Статика 5. Механіка 5.4. Статика 5.4.9. Види рівноваги А) Тіло не має осі обертання. Рівновага тіла стійка, якщо при малому відхиленні від положення рівноваги виникає сила, що повертає тіло в попереднє положення. Рівновага тіла нестійка, якщо при малому відхиленні від положення рівноваги виникає сила, що віддаляє тіло від попереднього положення. Рівновага тіла байдужа, якщо при зміні […]...
- Іонний добуток води – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага Рівновага, яка виникає в процесі протолізу, залежить від температури, хімічної природи реагентів і зміщується в бік утворення стійкіших сполук. 2.1. Іонний добуток води Молекула води, згідно теорії Бренстеда, може виступати як кислота або як основа. І навіть у чистій воді відбувається так званий автопротоліз (грец. autos – сам): Проте […]...
- Порядок реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції 3.2 . Порядок реакції На основі теорії зіткнення для різних типів молекулярних реакцій можна записати вирази для швидкості реакції: Константа k – константа швидкості реакції. Через спільний вплив різних чинників на швидкість реакції результати експериментів часто не відповідають теоретичним припущенням. Тому певна реакція описується експериментально виведеним рівнянням (виразом) […]...
- ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ Швидкість і механізм хімічної реакції вивчає хімічна кінетика. Швидкість хімічної реакції характеризується зміною концентрації однієї з вихідних речовин або кінцевих продуктів за одиницю часу. Середня швидкість реакції: Де с1 і с2 – початкова і кінцева концентрація речовини; τ1 і […]...
- Добуток розчинності – Рівновага розчинності ХІМІЧНА РІВНОВАГА 3. Рівновага розчинності 3.2 . Добуток розчинності Якщо до насиченого розчину солі у воді ще додати цю ж сіль, то ця добавка випаде в нерозчинений осад. Якщо до нього додати сіль, що містить один з іонів розчиненої солі, то утвориться такий самий осад. Приклад. Якщо до насиченого розчину кальцій сульфату додати трохи кальцій […]...
- Хімічна рівновага ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.6. Хімічна рівновага Оборотні реакції не доходять до кінця і завершуються встановленням хімічної рівноваги. Наприклад, у реакції синтезу аміаку (див. § 10.4) рівновага настає тоді, коли за одиницю часу утворюється стільки само молекул аміаку, скільки їх […]...
- Фактори, що впливають на швидкість реакції ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.2. Фактори, що впливають на швидкість реакції Швидкість хімічної реакції залежить від природи речовин, що реагують, і умов перебігу реакції: концентрації с, температури t, наявності каталізаторів, а також від деяких інших факторів (наприклад, від тиску – […]...
- КАТАЛІЗ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ КАТАЛІЗ Каталіз – це зміна швидкості хімічної реакції речовинами (каталізаторами), які беруть участь у реакції, але не входять до складу кінцевих продуктів. За участю каталізатора хімічна рівновага системи досягається швидше, ніж без нього. Вплив у каталізатора на швидкість реакції досягають за рахунок […]...
- Швидкість хімічної реакції – Хімічні реакції Хімія Загальна хімія Хімічні реакції Швидкість хімічної реакції Швидкість хімічної реакції Визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. Формула середньої швидкості хімічної реакції: де – середня швидкість хімічної реакції, – зміна концентрації реагенту, – час. Чинники, що впливають на швидкість хімічної реакції 1) Природа реагуючих речовин. 2) Агрегатний стан реагуючих речовин. […]...
- Як вирішується проблема економічної рівноваги за Е. Чемберліном? Історія економічних вчень ЕВОЛЮЦІЯ НЕОКЛАСИЧНОЇ ТЕОРІЇ XX ст. Як вирішується проблема економічної рівноваги за Е. Чемберліном? Проблему економічної рівноваги Чемберлін вирішує з неокласичних позицій. Він дотримується неокласичного погляду про те, що рівновага на ринку досягається за рахунок вільного ціноутворення. Дуже важливим висновком Чемберліна є те, що монополістична конкуренція диференційованих продуктів включає елементи досконалої конкуренції і […]...
- УМОВИ І ВИДИ РІВНОВАГИ ТВЕРДОГО ТІЛА – МЕХАНІКА ТВЕРДОГО ТІЛА Фізика підготовка до ЗНО комплексне видання МЕХАНІКА 2. ОСНОВИ ДИНАМІКИ 2.4. МЕХАНІКА ТВЕРДОГО ТІЛА 2.4.2. УМОВИ І ВИДИ РІВНОВАГИ ТВЕРДОГО ТІЛА Загальна умова рівноваги тіла. Для того щоб тіло перебувало в рівновазі, необхідно, щоб дорівнювали нулю геометрична сума прикладених до нього сил і алгебраїчна сума моментів сил відносно можливої осі обертання: Виконання цих умов не […]...
- Швидкість хімічної реакції – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Швидкість хімічної реакції Хімічні реакції відрізняються одна від одної тривалістю їхнього протікання. Деякі хімічні реакції відбуваються миттєво (наприклад, вибух воднево-кисневої суміші, реакції обміну з утворенням осаду), інші – досить швидко (горіння речовин), треті – повільно (більшість реакцій […]...
- ВПЛИВ ТЕМПЕРАТУРИ НА НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ВПЛИВ ТЕМПЕРАТУРИ НА НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ Згідно з рівнянням На значення ΔG великий вплив має температура. Цей вплив визначається знаком і величиною ΔS. При ΔS > 0 з підвищенням температури (збільшенням Т) негативне значення ΔG буде зменшуватися, а при ΔS < 0 – збільшуватися. Приклад реакції, […]...
- Швидкість хімічної реакції. Каталізатор – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.8. Швидкість хімічної реакції. Каталізатор Розділ хімії, що вивчає швидкість хімічних реакцій, називають хімічною кінетикою. Розгляньмо зміст деяких понять, які використовують у цьому розділі. Швидкість хімічних реакцій характеризується зміною концентрації реагентів (або продуктів реакції) за одиницю часу. Якщо реакції відбуваються […]...
- ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ – КИСЕНЬ Хімія – універсальний довідник КИСЕНЬ ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ Реакції, що супроводжуються виділенням теплоти, називаються екзотермічними. Наприклад, Реакції, що супроводжуються поглинанням теплоти, називаються ендотермічними. Наприклад, Кількість теплоти, що виділяється або поглинається в реакції, називається тепловим ефектом реакції. Тепловий ефект реакції ΔН – це різниця між вмістом енергії у вихідних речовинах і кінцевих продуктах реакції. Тепловий […]...
- Хімічна рівновага – Оборотність хімічних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.9. Оборотність хімічних реакцій За цією ознакою розрізняють: – реакції, які за однакових умов відбуваються у двох протилежних напрямках, називають оборотними. Наприклад, реакція синтезу сульфур(VI) оксиду (знак вказує саме на оборотність реакції): – необоротними називають реакції, які відбуваються тільки в […]...
- Обчислення за рівнянням хімічної реакції, якщо один з реагентів узято в надлишку РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ VIIA ГРУПИ § 22. Обчислення за рівнянням хімічної реакції, якщо один з реагентів узято в надлишку Усвідомлення змісту цього параграфа дає змогу: розв’язувати задачі на надлишок. Розглянемо рівняння реакції водню з хлором: За яким водень масою 2 г реагує з хлором масою 71 г з утворенням […]...
- ХІМІЧНА РІВНОВАГА – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ ХІМІЧНА РІВНОВАГА Реакція окиснення діоксиду сульфуру – оборотна. Це означає, що через деякий час після початку реакції в системі встановлюється рівновага: швидкість утворення SО3 дорівнює Швидкості його розкладання на SO2 і O2: За високої температури переважно протікає реакція розкладу (рівновага зміщена вліво), і в рівноважній суміші вміст продукту […]...