Стійкість електронних шарів. Перетворення атомів на йони – Електрон. Електронні шари
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
2. Будова атома
2.4. Електрон. Електронні шари
2.4.3. Стійкість електронних шарів. Перетворення атомів на йони
Найстійкішою електронною конфігурацією атома є така, при якій у зовнішньому електронному шарі розміщується 2 (як р атома Гелію) або 8 е – (як в атомах інших інертних газів). Восьмиелектронний зовнішній шар атома називають електронним октетом. Під час хімічних реакцій атоми прагнуть отримати саме таку найстійкішу електронну
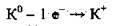
Електронна формула атома Калію – 40К 1s2 2s2 2p6 3s2 3р6 4s1. На останньому енергетичному рівні в атомі розміщується один електрон, а на передостанньому – вісім (октет). Під час хімічний реакцій атом Калію втра: чає саме один електрон (4s1), перетворюючись на позитивно заряджений іон – катіон Калію К+:
Атоми неметалічних елементів, які мають у зовнішньому електронному шарі 4-7 електронів, під час хімічних реакцій приєднують один або декілька електронів, одержують негативний заряд і перетворюються на негативно заряджені йони – аніони, Наприклад, атом Оксигену має таку електронну формулу: 8О 1s22s22p4. До завершення електронного шару йому не вистачає двох електронів. Під час хімічних реакцій атом Оксигену приєднує ці два електрони:
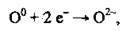
Перетворюючись на негативно заряджений іон – амніон Оксигену О2-:
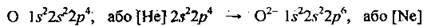
Радіуси катіонів менші від радіусів відповідних атомів (оскільки зменшується кількість електронних шарів). Радіуси аніонів і відповідних атомів майже однакові.
Related posts:
- Збуджений стан атома – Електрон. Електронні шари ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 2. Будова атома 2.4. Електрон. Електронні шари 2.4.2. Збуджений стан атома При збудженні атомів електрони набувають більшої енергії, відбувається перехід електронів з нижчих енергетичних підрівнів на вищі. Так, в атома Сульфуру є вільні d-орбіталі, тому можливий перехід одного зі спарених електронів з 3p-орбіталі […]...
- Послідовність заповнення орбіталей електронами – Електрон. Електронні шари ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 2. Будова атома 2.4. Електрон. Електронні шари Сучасна теорія електронної будови атома грунтується, на важливому розділі фізики – квантовій механіці, який описує властивості мікроскопічних об’єктів. Згідно з уявленнями квантової механіки, електрон як мікрочастинка має двоїсту природу: виявляє властивості частинки і хвилі. Розглядається не […]...
- Досягнення моделі будови електронних оболонок атомів – Модель будови електронних оболонок атомів БУДОВА АТОМА 5 . Модель будови електронних оболонок атомів Основні припущення теорії Бора можна перенести в якісному відношенні на прості системи з декількома валентними електронами, наприклад, такі як атоми лужних металів. – Електрони розташовуються навколо ядра на оболонках (шарах). – Усього в атомах розрізняють до семи оболонок (шарів). – Кожна оболонка є певним рівнем енергії […]...
- АТОМИ. ЙОНИ Розділ 1 ФІЗИКА ЯК ПРИРОДНИЧА НАУКА. ПІЗНАННЯ ПРИРОДИ &9. АТОМИ. ЙОНИ Хоча молекули й дуже маленькі частинки, але й вони діляться. Частинки, з яких складаються молекули, називають атомами. Атом – це найдрібніша частинка речовини, яка зберігає властивості самої речовини. Вирішальну роль у розкритті будови атома відіграли досліди, які провів у 1911 р. основоположник ядерної фізики […]...
- Атоми. Молекули. Йони Контрольні запитання № 1. Речовини складаються з атомів, молекул, йонів. № 2. Атоми – це найдрібніші електронейтральні частинки речовини, які складаються з позитивно зарядженого ядра й негативно заряджених електронів, що рухаються навколо ядра. Молекули – це найдрібніші частинки речовини, що здатні існувати самостійно і є носіями властивостей речовин. Йони – це одноатомні або багатоатомні частинки, […]...
- Валентність атомів – Здатність атомів утворювати сполуки ХІМІЧНИЙ ЗВ’ ЯЗОК 1.2 . Валентність атомів Якщо один атом з’єднується з іншим атомом, то залежно від виду атомів утворюються іони або молекули. – При утворенні іонного зв’язку валентні електрони приймаються або віддаються повністю. – При утворенні молекул валентні електрони йдуть на утворення спільних електронних пар. Число хімічних зв’язків за рахунок отриманих або відданих електронів, […]...
- Електронна будова атомів металічних елементів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали Металічних елементів більше, ніж неметалічних: зі 118 відомих на початок 2012 р. елементів понад 90 – металічні. Усі металічні елементи утворюють прості речовини – метали. 8.1.1. Електронна будова […]...
- Будова електронних оболонок атомів. Енергетичні рівні й підрівні Тема 3 ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. БУДОВА АТОМА УРОК 47 Тема. Будова електронних оболонок атомів. Енергетичні рівні й підрівні Цілі уроку: розширити уявлення учнів про будову атомів; навчити складати електронні формули, схеми розподілу електронів по квантових комірках для елементів I-III періодів; формувати вміння учнів визначати електронну будову атома за […]...
- Будова електронних оболонок атомів Тема 3 ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. БУДОВА АТОМА УРОК 48 Тема. Будова електронних оболонок атомів Цілі уроку: розвивати навички складання електронних формул, схем розподілу електронів по квантових комірках для елементів I-III періодів; продовжити формування вмінь і навичок учнів з визначення електронної будови атома за його положенням у періодичній системі […]...
- Будова електронних оболонок атомів і структура Періодичної системи Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ БУДОВА АТОМА Будова електронних оболонок атомів і структура Періодичної системи Число хімічних елементів у періодах Структура Періодичної системи повністю обумовлюється принципами будови електронної оболонки атомів. Число хімічних елементів, що містяться в кожному періоді, визначається місткістю відповідних енергетичних шарів. Число орбіталей на кожному енергетичному […]...
- Будова електронних оболонок та властивості хімічних елементів Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ БУДОВА АТОМА Будова електронних оболонок та властивості хімічних елементів Металічні й неметалічні елементи Хімічні властивості елементів обумовлюються не всіма електронами, а тільки тими, які мають найбільшу енергію. Ці електрони називають валентними. В атомах елементів головних підгруп валентними е електрони зовнішнього енергетичного рівня. Завершені […]...
- Будова електронних оболонок атомів РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ § 4. Будова електронних оболонок атомів Усвідомлення змісту цього параграфа дає змогу: Пояснювати значення понять “електронна оболонка атома”, “квантове число”, “електронна конфігурація атома”; характеризувати закономірності розподілу електронів у атомах; складати схеми будови атомів, електронні формули атомів хімічних елементів і електронно-графічні формули. Пригадаємо, що атом […]...
- Будова електронних оболонок атомів ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ § 2.6. Будова електронних оболонок атомів Тепер розглянемо будову окремо взятого електронного рівня (шару). Починаючи із значення головного квантового числа n = 2, енергетичні рівні (шари) поділяються на підрівні (підшари), що відрізняються […]...
- Складання формул сполук за відомим ступенем окиснення атомів елементів Тема 4 ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ УРОК 63 Тема. Складання формул сполук за відомим ступенем окиснення атомів елементів Цілі уроку: закріпити навички складання хімічних формул за відомими ступенями окиснення атомів, визначення ступенів окиснення; розширити уявлення про хімічні реакції на прикладі хімічних реакцій зі зміною ступеня окиснення атомів; показати єдність двох процесів – окиснення й […]...
- РОЗМІР АТОМІВ Хімія – універсальний довідник БУДОВА АТОМА РОЗМІР АТОМІВ Атоми мають дуже малі розміри, порядку часток нанометра (1 нм = 10-9 м). Наприклад, радіус атома Феруму складає 0,13 нм. Розміри атомів у твердій речовині можна вирахувати, знаючи густину речовини р, з якої може бути знайдено молярний об’єм речовини VM = М/ρ і потім обчислено об’єм, що […]...
- Валентність атомів елементів. Визначення валентності й складання хімічних формул за валентністю атомів елементів Хімія Загальна хімія Основні поняття, закони й теорії хімії Валентність атомів елементів. Визначення валентності й складання хімічних формул за валентністю атомів елементів Валентність – це властивість атомів хімічного елемента утворювати хімічні зв’язки з певним числом атомів інших хімічних елементів. За одиницю валентності прийнята валентність атома Гідрогену. Він одновалентний, тобто може утворювати тільки один зв’язок. Кількісне […]...
- Хімічні формули речовин № 1. Хімічна формула – це умовний запис складу речовини за допомогою символів хімічних елементів та індексів. За допомогою хімічних формул записують склад речовин. № 2. Індекс показує число атомів в молекулі. Індекс записується маленькою цифрою праворуч від символа елемента. № 3,4. Для речовин молекулярної будови хімічна формула відображає склад молекули речовини, а для речовин […]...
- Електронні формули ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ § 2.7. Електронні формули Розподіл електронів в атомі на енергетичних рівнях і підрівнях зображують у вигляді електронних формул. Покажемо, як їх скласти. Кожний електрон в атомі займає вільну орбіталь з найнижчою енергією, […]...
- Ковалентний зв’язок Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ Ковалентний зв’язок Утворення ковалентного зв’язку При утворенні хімічного зв’язку атоми прагнуть до того, щоб на їхньому зовнішньому енергетичному рівні було два (у випадку з Гідрогеном) або вісім (октет) електронів. Цього можна досягти кількома способами. Найпоширеніший з них полягає […]...
- Ядерна модель будови атомів ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ § 2.3. Ядерна модель будови атомів До кінця XIX ст. атоми вважалися неподільними. Потім, з нагромадженням експериментальних даних, довелося відмовитися від такого погляду і визнати, що атоми мають складну будову. Новий погляд […]...
- СПОЛУЧЕННЯ АТОМІВ МІЖ СОБОЮ. УТВОРЕННЯ ХІМІЧНОГО ЗВ’ЯЗКУ Хімія – універсальний довідник БУДОВА АТОМА СПОЛУЧЕННЯ АТОМІВ МІЖ СОБОЮ. УТВОРЕННЯ ХІМІЧНОГО ЗВ’ЯЗКУ Як і чому відбувається сполучення нейтральних атомів? Почнемо пояснення з найпростішого випадку. Нехай на деякій відстані один від одного (наприклад, 0,1нм) знаходяться два протони – два ядра атома Гідрогену. У чому полягатиме їх взаємодія? Звичайно, вони будуть відштовхуватися, тому що заряджені однойменно. […]...
- СХЕМА ХІМІЧНОЇ РЕАКЦІЇ. РІВНЯННЯ ХІМІЧНИХ РЕАКЦІЙ № 1. Хімічне рівняння – це умовний запис хімічної реакції (хімічного явища) за допомогою хімічних формул, коефіцієнтів і знаків “+” “-” та “=”. Знак “=” вказує на те, що кількість атомів кожного хімічного елемента у лівій та правій частині хімічного рівняння однакова. № 2. Рівняння хімічної реакції відрізняється від її схеми тим, що у рівнянні […]...
- БУДОВА АТОМІВ ЛУЖНИХ МЕТАЛІВ – ЛУЖНІ МЕТАЛИ Хімія – універсальний довідник ЛУЖНІ МЕТАЛИ Лужними металами називаються елементи ІА групи. Якщо галогени є типовими, найяскравіше вираженими неметалами, то елементи ІА групи – це типові метали. БУДОВА АТОМІВ ЛУЖНИХ МЕТАЛІВ З елемента ІА групи розпочинається кожен період у таблиці Д. І. Менделєєва. Це означає, що саме в атомах цих елементів розпочинається заповнення наступного енергетичного […]...
- БУДОВА АТОМІВ ГАЛОГЕНІВ Хімія – універсальний довідник ГАЛОГЕНИ Галогенами називаються хімічні елементи VІІА групи. Ця загальна назва походить від грец. “галс” – сіль і “генес” – той, що народжує, тобто “солероди”. У галогенів яскравіше порівняно з іншими елементами виражені властивості неметалів. Кажуть, галогени – типові неметали. БУДОВА АТОМІВ ГАЛОГЕНІВ З галогенів у періодичній системі елементів першим розташований Флуор […]...
- ВАЛЕНТНІСТЬ І ЕЛЕКТРОННА БУДОВА АТОМІВ Хімія – універсальний довідник ВІД НАТРІЮ ДО АРГОНУ ВАЛЕНТНІСТЬ І ЕЛЕКТРОННА БУДОВА АТОМІВ Для схематичного зображення електронної будови атомів часто використовується наступна форма: записують символ елемента і навколо нього крапками позначають електрони зовнішнього валентного рівня. Для елементів 3-го періоду такий запис матиме вигляд: Розглянемо валентності, які можуть проявляти атоми цих елементів. Як зазначалося вище, за […]...
- Енергія іонізації та спорідненість до електрона – Здатність атомів утворювати сполуки ХІМІЧНИЙ ЗВ’ ЯЗОК В основі всіх типів хімічного зв’язку лежать електричні сили тяжіння, вони розрізняються між собою тільки за силою. А ця сила у свою чергу визначається типом наявних частинок (атомів, молекул, іонів). Розрізняють п’ять типів хімічного зв’язку. Який з них діє в конкретному випадку, залежить від типу зв’язаних одна з одною частинок. Існують, перш […]...
- Електронегативність – Здатність атомів утворювати сполуки ХІМІЧНИЙ ЗВ’ ЯЗОК 1.3. Електронегативність Енергія іонізації показує, наскільки легко атом втрачає електрон. Спорідненість до електрона визначає здатність нейтрального атома приймати електрон. Електронегативність (ЕН) визначає розподіл електронів в існуючому хімічному зв’язку. Вона є мірою здатності атома залучати валентні електрони до спільного зв’язку. Для оцінки ступеня електронегативності була створена відносна шкала від 1,0 для Літію до […]...
- Склад атома Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ БУДОВА АТОМА Склад атома Атоми складаються з позитивно зарядженого ядра та електронів. Електрон – найлегший з відомих елементарних частинок. Його маса (9,1 ∙ 10-31 кг) У 1837 разів менша від маси найлегшого з атомів – атома Гідрогену. Електричний заряд електрона називають елементарним – […]...
- Вправа 65-72 № 65. Маса атома – важлива характеристика атома. Відносна атомна маса – маса атома елемента в порівнянні з 1/12 масою атома Карбону. № 67. Запис Аr – відносна атомна маса (а. о. м), Аг – символ елементу Аргону. № 68. Be → Аг = 9. Al → Аr =27. Легший атом Берилію у 3 рази. […]...
- Періодичний закон і періодична система елементів у світлі вчення про будову атомів ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ § 2.9. Періодичний закон і періодична система елементів у світлі вчення про будову атомів Вчення про будову атомів розкрило глибокий фізичний зміст періодичного закону. Як зазначалося у § 2.4, головною характеристикою атома […]...