Сучасна модель стану електрона в атомі
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ
§ 2.5. Сучасна модель стану електрона в атомі
Під час хімічних реакцій ядро атома не змінюється. Змін зазнають електронні оболонки атомів, будовою яких пояснюється багато властивостей хімічних елементів. Тому стану електронів в атомі й структурі електронних оболонок завжди приділяється велика увага під час вивчення хімії.
Стан електрона в атомі описується квантовою механікою,
Електрон в атомі не має траєкторії руху. Квантова механіка розглядає
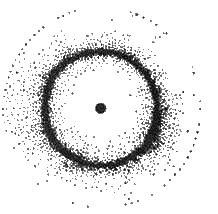
Рис. 2.2. Електронна хмара гідрогену з нерівномірною густиною
Найбільшу густину. Максимальна густина відповідає ймовірності перебування електрона в даній частині атомного простору. На рис. 2.2 зображено модель поперечного перерізу атома гідрогену з погляду квантової механіки. Видно, що поблизу ядра електронна густина практично дорівнює нулю, тобто електрон тут майже не буває. В міру віддалення від ядра електронна густина зростає і досягає максимального значення на відстані 0,053 нм, а потім поступово спадає. Значить, найбільш імовірне перебування електрона, що рухається, на відстані 0,053 нм від ядра (на рисунку – темніші місця). Чим міцніше зв’язаний електрон з ядром, тим більшу густину за розподілом заряду і тим менші розміри повинна мати електронна хмара.
Простір навколо ядра, в якому перебування електрона найімовірніше, називається орбіталлю1.
1 Термін прийнято в 1962 р. замість терміна “орбіта”.
У ньому міститься = 90 % електронної хмари. Це означає, що близько 90 % часу електрон перебуває в цій частині простору. Орбіталі атома мають різні розміри. Очевидно, що електрони, які рухаються в орбіталях меншого розміру, сильніше притягуються ядром, ніж електрони, що рухаються в орбіталях більшого розміру. Електрони, які рухаються в орбіталях близьких розмірів, утворюють електронні шари. Електронні шари називають також енергетичними рівнями. Енергетичні рівні нумерують, починаючи від ядра: 1, 2, 3, 4, 5, 6, 7. Іноді їх позначають літерами відповідно К, L, М, N, О, Р, О. Ціле число n, яке означає номер рівня, називається головним квантовим числом. Воно характеризує енергію електронів, що займають даний енергетичний рівень. Найменшу енергію мають електрони першого енергетичного рівня, най ближчого до ядра. Порівняно з електронами першого рівня електрони наступних рівнів характеризуються більшим запасом енергії. Очевидно, слабкіше зв’язані з ядром електрони зовнішнього рівня.
Число енергетичних рівнів в атомі, заповнених електронами, чисельно дорівнює номеру періоду, в якому перебуває елемент: в атомів елементів І періоду – один енергетичний рівень, II періоду – два, III періоду – три і т. д. Найбільше число електронів на енергетичному рівні дорівнює подвоєному квадрату номера рівня, тобто
N = 2n2, (2.2)
Де N – число електронів; л – номер рівня (рахуючи від ядра), або головне квантове число.
Відповідно до рівняння (2.2) на першому, найближчому до, ядра, енергетичному рівні може розміститися не більше 2 електронів, на другому – не більше 8, на третьому – не більше 18, на четвертому – не більше 32.